العلاقة بين الكهروسالبية ونوع الرابطة
الجدول التالي يحدد الروابط المتكونة فى المركبات بناءاً على الفرق فى السالبية الكهربية للعناصر المكونة للرابطة.
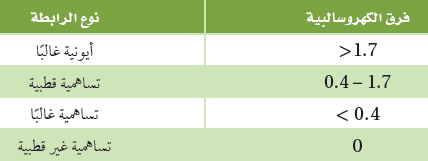
- أحيانًا تكون الرابطة غير واضحة ما إذا كانت أيونية أو تساهمية. فإذا كان الفرق في الكهروسالبية يساوي 1.7 أو مقارب له.
أولاُ: الرابطة فى كلوريد الصوديوم NaCl
- السالبية الكهربية للكلور = 3.16 ، السالبية الكهربية للصوديوم = 0.93
- الفرق في السالبية الكهربية بين أيونات الكلور والصوديوم = 3.16 - 0.93 = 2.23 أى أكبر من 1.7
- لذلك الرابطة المتكونة هنا هي رابطة آيونية مما يعنى أن مركب كلوريد الصوديوم مركباً آيونياً صرفاً فيكون موصلاً جيداً للكهرباء.
ثانياً/ الرابطة فى كلوريد الألومنيوم AlCl3
- السالبية الكهربية للكلور = 3.16 ، السالبية الكهربية للألومنيوم = 1.61
- الفرق في السالبية الكهربية بين أيونات الكلور والصوديوم = 3.16 - 1.61 = 1.55
- ولهذا فأن هذا الفرق فى السالبية الكهربية (1.55) يقع بين الحد الفاصل بين الرابطة الأيونية والرابطة التساهمية (1.7).
- لذلك يكون الرابطة في كلوريد الألومنيوم رابطة أيونية بخصائص تساهمية عالية جداً Ionic bond with Covalent character ولذلك يقال أن الرابطة المتكونة فى هذة الحالة رابطة تساهمية.( أو رابطة أيونية بصفات تساهمية).
- الرابطة المتكونة فى كلوريد الألومنيوم تجعله أقرب إلى صفات المركبات التساهمية منه إلى الأيونية ، فيكون توصيله الكهربي محدوداً.
دور الفرق فى السالبية الكهربية فى تكوين الروابط
- بناءاً على الفرق فى السالبية الكهربية تتحدد الروابط بين عنصر الكلور والعناصر الآتية: الصوديوم - الماغنسيوم - الألومنيوم.

الفرق بين الرابطة الأيونية والرابطة التساهمية
