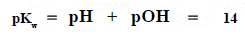تأين الماء Ionization of Water
- الماء النقي الكتروليت ضعيف يوصل التيار الكهربي توصيلاً ضعيفاً ويعبر عن تأينه بالأتزان التالي:
(2H2O(l) ↔ H3O+(aq) + OH-(aq
وللتبسيط يمكن كتابة المعادلة السابقة كالتالي:
(H2O(l) ↔ H+(aq) + OH-(aq
ويعبر عن ثابت الاتزان كما يلي:
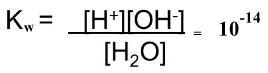
ونظراً لأن مقدار ما يتأين من الماء لا يذكر كما يتضح من قيمة ثابت الاتزان فإن تركيز الماء غير المتأين يعتبر مقداراً ثابتاً ومن ثم يؤول التعبير السابق إلى العلاقة التالية بعد إهمال تركيز الماء غير المتأين والذي يعتبر ثابت في ثابت الاتزان:
Kw = [H+] [OH-] = 10-14
وحيث إن الماء النقي متعادل التأثير على عباد الشمس فيكون تركيز أيون الهيدروجين المسئول عن الحموضة مساوياً لتركيز أيون الهيدروكسيل المسئول عن القلوية ولذلك فإن :
Kw = [10-7] [10-7] = 10-14
الحاصل الأيوني للماء Kw
- هو حاصل ضرب تركيزى أيون الهيدروجين وأيون الهيدروكسيل الناتجين من تأين الماء ويساوي = 14-10
- هو مقدار ثابت فإذا زاد تركيز أيون الهيدروجين قل تركيز أيون الهيدروكسيل بنفس المقدار وإذا عرف تركيز أحد الأيونين أمكن معرفة تركيز الآخر.
الرقم الهيدروجيني pH
- هو اللوغارتيم السالب لتركيز أيون الهيدروجين
[+pH = - log [H
- الحرف (p) يعني log-
- وهو أسلوب للتعبير عن درجة الحموضة أو القاعدية للمحاليل المائية فإذا رجعنا لمعادلة الحاصل الأيوني للماء وبأخذ اللوغارتيم السالب لهذة المعادلة فإنها تصبح:
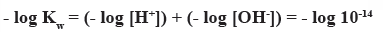
وباستبدال القيمة log- بالحرف (p) فإن المعادلة تصبح: