قاعدة الثمانيات Octet rule
- تنص قاعدة الثمانيات على: تميل جميع الذرات للوصول إلى التركيب الثماني لأقرب غاز خامل ماعدا الهيدروجين والبريليوم والليثيوم )
- تميل الذرات لأن ترتبط بالطريقة التي تجعل فيها 8 إلكترونات في غلاف تكافؤها، مماثل للتركيب الإلكتروني الموجود في الغازات النبيلة. وبمعنى أبسط تكون الجزيئات أكثر استقراراً عندما يكون الغلاف الخارجي للذرات المكونة لها فارغة أو ممتلئة أو بها إلكترونات بمضاعفات 8 إلكترونات في غلافها الأخير.
- يحدث هذا بصفة أساسية في الرابطة الأيونية و الرابطة التساهمية.
- يمكن تطبيق قاعدة الثمانيات على العناصر الآتية: الكربون، C ، الأكسجين O ،الهالوجينات مثل: الفلور و الكلور .
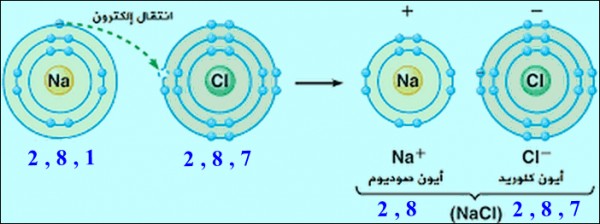
- مثال: فى مركب كلوريد الصوديوم يحتوى الصوديوم على الكترون واحد فى مستوى الطاقة الأخير فيميل إلى فقده واعطائه لذرة الكلور التى تحتوى على سبعة الكترونات ليكون مستوى الطاقة الخارجى لأيون الصوديوم الموجب ممتئل بثمانية ألكترونات ليصل الى التركيب الثماني لأقرب غاز خامل وهو النيون10 كما يكتمل مستوى الطاقة الخارجى لأيون الكلور السالب بثمانية الكترونات لتصل غلى التركيب الثماني لأقرب غاز خامل وهو الارجون 18 وتتكون الرابطة الأيونية فى مركب كلوريد الصوديوم
عيوب نظرية الثمانيات
لهذه النظرية يوجد لها استثناءات كبيرة:
(1) لا تطبق القاعدة على الهيدروجين والليثيوم وذلك لأن الهيدروجين يحتاج إلى إلكترون واحد فقط ليصل لأقرب غاز نبيل (الهيليوم), كما أن الليثيوم يحتاج ليفقد إلكترون ليصل لمثل هذا التركيب.
(2) لا تطبق القاعدة على الجزيئات والشوارد التي لها رقم فردي من الإلكترونات.
(3) لا تطبق القاعدة على أي من الجزيئات التي تكون أكثر من أربعة روابط (مثل الفسفور)
(4) لا يمكن تطبيق نظرية الثمانيات على العناصر الموجودة في الدورات الأعلى من الثانية لأن غلافها الإلكتروني يمكن أن يكون به أكثر من ثمانية إلكترونات.
(5) للفلزات الانتقالية بديل لنظرية الثمانيات وهو عدد الإلكترونات.
(6) البورون يعتبر أيضا استثناء.
(7) كما يوجد أيضا استثناء في مواد معروفة، مثل أول أكسيد الكربون والأوزون.
مكتشف قاعدة الثمانيات
هو لويس وكوسيل 1916 وتسمى النظرية الإلكترونية للتكافؤ أو قاعدة الثمانيات.