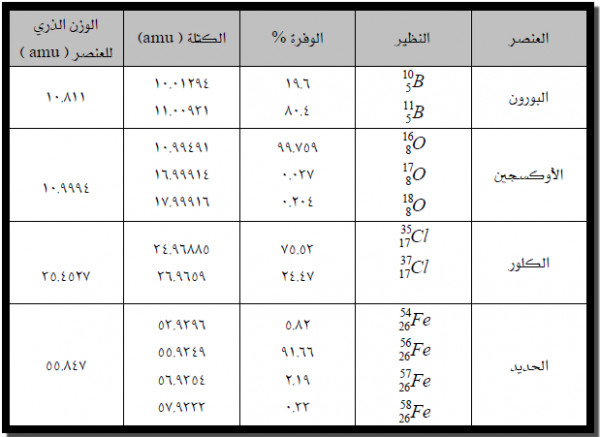
الكتلة الذرية ( متوسط الوزن الذري)
- لأن كتلة الذرة تعتمد أساساً على عدد البروتونات وعدد النيوترونات فيها.
- ولأن كتلة كل من البروتون والنيوترون قريبة من 1amu
- فقد تتوقع أن الكتلة الذرية هي دائماً عدد صحيح! لكن هذا ليس صحيحًا؛
- إذ إن الكتلة الذرية للعنصرهي متوسط كتل نظائر العنصر.
- ولأن للنظائر كتلاً مختلفة فإن متوسط الكتلة الذرية ليس عدداُ صحيحاً.
- قانون حساب الكتلة الذرية لأى عنصر:
الكتلة الذرية = الوفرة % × الوزن الذري للنظير الأول + الوفرة % × الوزن الذري للنظير الثاني + الوفرة % × الوزن الذري للنظير الثالث
مثال (1) : حساب الكتلة الذرية للكلور.
- يوجد الكلور فى الطبيعة مزيجاُ من 76% كلور-35 ، 24% كلور-37
- الكتلة الذرية للكلور = 35.453 amu
- يبين الشكل التالي حساب الكتلة الذرية للكلور.

مثال (2) : الكتلة الذرية للعنصر X
أذا كان لديك عنصر X وكنت له النظائر كما بالشكل التالي فأن :

مثال (3) : حساب الكتلة الذرية لعنصر الماغنسيوم
يتكون عنصر المغنسيوم من ثلاث نظائر طبيعية، الأوزان الذرية والنسبة المئوية لوفرة هذه النظائر موضحة بالجدول التالي.
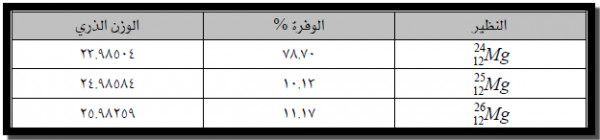
الوزن الذري = الوفرة % × الوزن الذري للنظير الأول + الوفرة % × الوزن الذري للنظير الثاني + الوفرة % × الوزن الذري للنظير الثالث
٢٥٫٩٨٢٥٩ × ٠٫١١١٧ + ٢٤٫٩٨٥٨٤× ٠٫١٠١٣ + ٢٣٫٩٨٥٠٤× ٠٫٧٨٧٠ =
٢٫٩٠٢ + ٢٫٥٣١ + ١٨٫٨٨ =
amu ٢٤٫٣١٣ =
الجدول التالي يوضح نظائر بعض العناصر والوزن الذري لكل عنصر