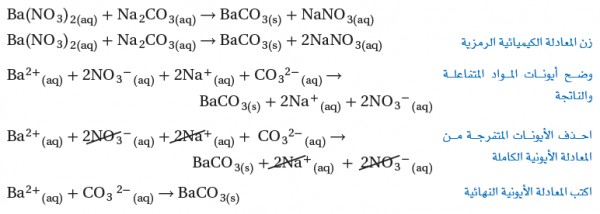المعادلات الآيونية Ionic equation
- تستخدم المعادلات الآيونية لتوضيح تفاصيل التفاعلات التي تتضمن أيونات في المحاليل المائية.
- تختلف المعادلات الأيونية عن المعادلات الكيميائية الرمزية الموزونة في أن المواد التى تكون على شكل أيونات فى المحلول تكتب كأيونات فى المعادلة.
- تشتمل المعادلة الأيونية النهائية على عدد أقل من المواد وتبين الأيونات المتفاعلة لتكوين الراسب (المادة الصلبة)
- المعادلة الكيميائية الرمزية الموزونة التالية:
↓ (2NaOH(aq) + CuCl2(aq) → 2NaCl(aq) + Cu(OH)2(s
- لكتابة المعادلة الأيونية للتفاعل السابق لابد أن يكتب المتفاعلات والناتج NaCl على شكل أيونات كالتالي:
(2Na+(aq) + 2OH-(aq) + Cu2+(aq) + 2Cl-(aq) → 2Na+(aq) + 2Cl-(aq) + Cu(OH)2(s
- وتسمى المعادلة التى تبين الجسيمات فى المحلول بالمعادلة الأيونية الكاملة.
- لاحظ أن أيونات الصوديوم والكلور مواد متفاعلة وناتجة في الوقت نفسه، أيْ أنها لم تشارك في التفاعل، ولهذا تسمى الأيونات المتفرجة.
- وعند شطب هذه الأيونات من طرفي المعادلة الأيونية تحصل على ما يسمى المعادلة الأيونية النهائية، وهي تشتمل على الجسيمات المشاركة في التفاعل فقط.
(2OH-(aq) + Cu2+(aq) → Cu(OH)2(s
لاحظ أنه لم يتبق سوى أيونات الهيدروكسيد والنحاس في المعادلة الأيونية النهائية.
مثال محلول: اكتب المعادلة الأيونية لتفاعل محلول نترات الباريوم مع محلول كربونات الصوديوم لتكوين راسباُ من كربونات الباريوم