تكوين الأيون الموجب Positive Ion Formation
- يتكون الايون الموجب عندما تفقد الذرة إلكترون تكافؤ واحدًا أو أكثر لتحصل على التوزيع الألكتروني المشابة للتوزيع الالكتروني لأقرب غاز خامل.
- يسمى الأيون الموجب بالكاتيون Cation.
- لفهم تكوين الأيون الموجب قارن بين التوزيع الإلكتروني لغاز النيون النبيل (العدد الذري يساوي 10) والتوزيع الإلكتروني لفلز الصوديوم القلوي (العدد الذري يساوي 11)
Ne10: 1s2 2s2 2p6
Na11 : 1s2 2s2 2p6 3s1
Na+ : 1s2 2s2 2p6
- لذرة الصوديوم إلكترون تكافؤ واحد في المستوى 3s ولذا فهي تختلف عن ذرة غاز النيون النبيل بهذا الألكترون الإضافي.
- عندما تفقد ذرة الصوديوم هذا الإلكترون، تحصل على توزيع إلكتروني مستقر مشابة مشابه للتوزيع الإلكتروني لذرة النيون.
- يوضح الشكل التالي كيف تفقد ذرة الصودؤوم إلكترون التكافؤ لتتحول إلى كاتيون:

- من الضروري معرفة أنه رغم حصول ذرة الصوديوم على توزيع إلكتروني مشابه للتوزيع الإلكتروني لذرة النيون إلا أنها لم تتحول إلى ذرة نيون، بل تحولت إلى أيون صوديوم أحادي الشحنة الموجبة، وأن عدد البروتونات (11) الذي يميز ذرة الصوديوم ما زال ثابتًا داخل النواة لم يتغير.
الأيونات الموجبة للفلزات Positive ions of metals
- إن ذرات الفلزات نشيطة كيميائيًّا؛ لأنها تفقد إلكترونات تكافئها بسهولة.
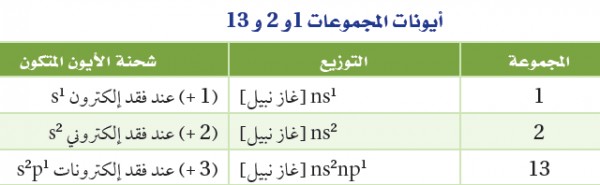
- فلزات المجموعتين الأولى والثانية أكثر الفلزات نشاطًا في الجدول الدوري وتكون أيونات موجبة.
فعلى سبيل المثال، تُكوِّن فلزات البوتاسيوم والماغنسيوم الموجودة فى المجموعتين 1 ،2 الأيونات +Mg+2 ، K
- تكون بعض ذرات عناصر المجموعة 13 أيونات موجبة أيضاُ.
- يلخص الجدول التالي الأيونات التي تكوّنها ذرات فلزات المجموعات 1 ، 2 ، 13 :
الأيونات الموجبة للفلزات الانتقالية
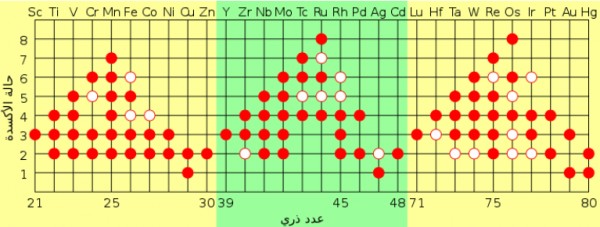
- تذكر أن مستوى الطاقة الخارجي للفلزات الانتقالية هو ns2 وعند الانتقال من اليسار إلى اليمين عبر الدورة تقوم ذرة كل عنصر بإضافة إلكترون إلى المستوى الثانوي (d) .
- عادة ما تفقد الفلزات الانتقالية إلكترونين من إلكترونات التكافؤ لتكون أيونات موجبة الشحنة (+2) وقد تفقد أيضاَ إلكترونات من المستوى (d). لذا تكوّن الفلزات الانتقالية أيونات موجبة ثلاثيةالشحنة (+3) أو حسب عدد إلكترونات المستوى (d) .ولكن من الصعب التنبؤ بعدد الإلكترونات التى يمكن فقدانها.
وعلى سبيل المثال : يكون الحديد أيونات +Fe2+ ،Fe3
- من المؤكد أنّ هذه الفلزات تكوِّن أيونات موجبة ثنائية أو ثلاثية الشحنة.
- على الرغم من أن أن توزيع الإلكترونات الثماني هو التوزيع الإلكتروني للذرة المستقرة الإ أنه يوجد توزيعات أخرى للإلكترونات تزودها ببعض الاستقرار.
على سبيل المثال: تفقد ذرات عناصر المجموعات 11 - 14 إلكترونات لتكون مستوي طاقة خارجياً ذا مستويات ثانوية (هي s ,p , d) .
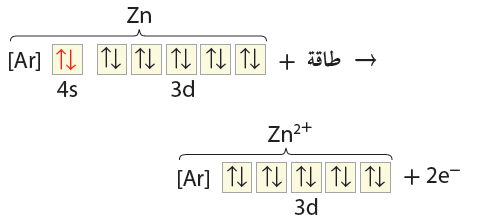
- يبين الشكل التالي التوزيع الألكتروني لذرة الخارصين وعندما تكون ذرة الخارصين الايون الثنائي الموجب تفقد إلكترونين من المستوى 4s وينتج التوزيع الالكتروني المستقر. ويشار إلى هذا التوزيع الإلكتروني المستقر نسبياً بالتوزيع الألكتروني الشبية بالغاز النبيل.
Zn30 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Zn+2 : 1s2 2s2 2p6 3s2 3p6 3d10
الشكل التالي يوضح أعدادالأيونات الموجبة التى يمكن أن تكونها الفلزات الأنتقالية