الروابط التساهمية الأحادية Single Covalent Bonds
- عندما يشترك زوج واحد من الإلكترونات في تكوين رابطة كما في جزئ الهيدروجين تعرف هذة الرابطة باسم الرابطة التساهمية الأحادية.
- عادة ما يُشار إلى زوج الإلكترونات المشترك بزوج إلكترونات الرابطة.
- وفي حال جزيء الهيدروجين المبين فى الشكل التالي تقوم كل ذرة هيدروجين بجذب زوج إلكترونات الرابطة بالمقدار نفسه. لذا ينتمي كلاً الإلكترونين المشتركين إلى كل من الذرتين في الوقت نفسه، مما يعطي كل ذرة هيدروجين في الجزيء التوزيع الألكتروني لغاز الهيليوم النبيل 1s2 ، فيصبح جزيء الهيدروجين أكثر استقرارًا من أي ذرة من ذرات الهيدروجين المنفردة.
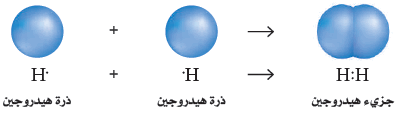
- يوضح التمثيل النقطي للإلكترونات تركيب لويس Lewis structure ترتيب إلكترونات التكافؤ في الجزيء، حيث يمثل كل خط أو زوج من النقط العمودية رابطة تساهمية واحدة. فعلى سبيل المثال، يمكن كتابة جزيء الهيدورجين هكذا H:H أو H- H
المجموعة (17) والروابط التساهمية الأحادية
- تضم الهالوجينات - عناصر المجموعة (17) - ومنها الفلور سبعة إلكترونات تكافؤ ، وتحتاج إلى إلكترون واحد للوصول إلى حالة الثمانية إلكترونات.
- لذا تكون ذرات عناصر المجموعة (17) رابطة تساهمية أحادية مع اللافلزات الأخري ، ومنها الكربون.
- ذرات عناصر المجموعة (17) تكون روابط تساهمية مع ذرات من النوع نفسه. على سبيل المثال ، ويوجد الفلور على صورة (F2) ، والكلور على صورة (Cl2)

المجموعة (16) والروابط التساهمية الأحادية
- تستطيع ذرات عناصر المجموعة (16) أن تشترك بإلكترونين وتكون رابطتين تساهميتين.
- الأكسجين أحد عناصر المجموعة (16) وتوزيعه الألكتروني هو 1s2 2s2 2p4
- يدخل الأكسجين في تركيب الماء الذي يتكون من ذرتي هيدروجين وذرة أكسجين:
يصبح لكل ذرة هيدروجين التوزيع الإلكتروني لغاز (الهيليوم) النبيل نفسه عندما تتشارك في إلكترون مع ذرة الأكسجين.
كما يصبح لذرة الأكسجين التوزيع الألكتروني للغاز النبيل (النيون) عندما تتشارك في إلكترون واحد مع كل ذرة هيدروجين.
- يوضح الشكل التالي تركيب لويس لجزيء الماء:
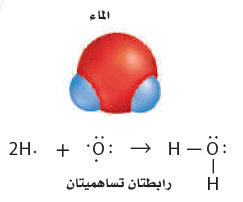
- لاحظ أن لذرة الأكسجين رابطتين تساهميتين أحاديتين وزوجين من الإلكترونات غير المترابطة.
المجموعة (15) والروابط التساهمية الأحادية
- تستطيع عناصر المجموعة (15) أن تكون ثلاث روابط تساهمية مع ذرات اللافلزات.
- النيتروجين من عناصر المجموعة (15) وتوزيعه الألكتروني 1s2 2s2 2p3
- غاز الأمونيا (النشادر) NH3 ثلاث روابط تساهمية أحادية ، حيث ترتبط ثلاثة إلكترونات من النيتروجين بثلاث ذرات من الهيدروجين تاركة زوجاً وحيداً من الألكترونات غير المشتركة على ذرة النيتروجين.
- يوضح الشكل التالي نموذج لويس لجزئ الأمونيا:
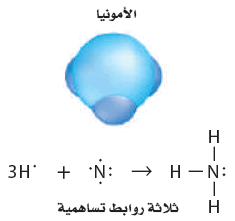
- يستطيع النيتروجين أيضاً تكوين مركبات مشابهة للأمونيا عند اتحاد بذرات عناصر المجموعة (17) مثل NF3 ثلاثي فلوريد النيتروجين ، وثلاثي كلوريد النيتروجين NCl3 ، وثلاثي بروميد النيتروجين NBr3.
- وتتشارك كل ذرة من عناصر المجموعة (17) مع ذرة نيتروجين من خلال زوج واحد من الإلكترونات.
المجموعة (14) والروابط التساهمية الأحادية
- تستطيع عناصر المجموعة (14) أن تكوّن أربع روابط تساهمية.
- يتكون جزيء الميثان CH4 عندما ترتبط ذرة كربون واحدة بأربع ذرات هيدروجين.
- للكربون (وهو عنصر فى المجموعة 14) التوزيع الإلكتروني 1s2 2s2 2p2 بواقع أربعة إلكترونات تكافؤ. لذا يحتاج الكربون إلى أربعة إلكترونات ليصل إلى التوزيع الإلكتروني المشابه للغاز النبيل (النيون). لذا عندما يتحد الكربون بالذرات الأخري يكون أربع روابط.
- ولأن الهيدروجين ، من عناصر المجموعة الأولى، وله إلكترون تكافؤ واحد فإن ذرة الكربون تحتاج إلى أربع ذرات هيدروجين للحصول عىل أربعة إلكترونات تحتاج إليها.
- يوضح الشكل التالي تركيب لويس للميثان:
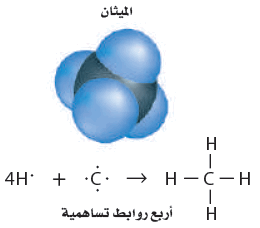
- كذلك يكوّن الكربون أربع روابط تساهمية أحادية مع اللافلزات الأخرى، ومنها عناصر المجموعة (17)
الرابطة سيجما (σ)
- تسمى الروابط التساهمية الأحادية روابط سيجما ، ويرمز إليها بالحرف الإغريقي (σ)
- تتكون رابطة سيجما عندما تتشارك ذرتان في الألكترونات وتتداخل مستويات تكافؤهما تداخلاً رأسياً (رأساً مقابل رأس) ، فتزداد الكثافة الإلكترونية في مستوى الربط بين الذرتين.
- تتكون رابطة سيجما عندما يتداخل :
(1) مستوى (s) مع مستوى (s) آخر
(2) مستوى (s) مع مستوى (P)
(3) مستوى (P) مع مستوى (P) آخر.
- تتكون الروابط سيجما فى جزيئات الماء (H2O) ، والأمونيا (NH3) ، الميثان (CH4) كما بالشكل:
