الروابط التساهمية المتعددة Multiple Covalent Bonds
- تكتسب الذرات في بعض الجزيئات التوزيع الألكتروني للغازات النبيلة عندما تشترك بأكثر من زوج من الإلكترونات مع ذرة أخرى أو أكثر.
- ينتج الروابط التساهمية المتعددة عن المشاركة بأكثر من زوج من الإلكترونات. فالروابط التساهمية الثنائية والثلاثية أمثلة على ذلك.
- إن عدد إلكترونات التكافؤ التي تحتاج إليها ذرة العنصر للوصول إلى الحالة الثمانية يكون مساويًا لعدد الروابط التساهمية الممكن تكوينها.
الروابط التساهمية الثنائية Double Covalent Bonds
- تتكون هذة الروابط عندما تشترك ذرتان بزوجين من الإلكترونات فيما بينهما .
- على سبيل المثال يوجد الأكسجين على شكل جزيئات ثنائية الذرات . ويوضح الشكل التالي أن لكل ذرة أكسجين ستة إلكترونات تكافؤ ، وتحتاج إلى إلكترونين لتصل إلى التوزيع الإلكتروني الخاص بالغاز النبيل (النيون).
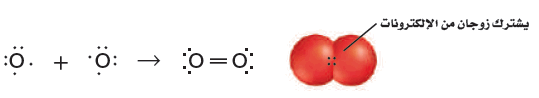
- لذا تتكون الرابطة التساهمية الثنائية عندما تقوم كل ذرة بالمشاركة بإلكترونين، ليصل المجموع إلى زوجين من الإلكترونات المشتركة بين الذرتين.
الروابط التساهمية الثلاثية Triple Covalent Bonds
تتكون هذة الروابط عندما تشترك ذرتان في ثلاثة أزواج من الألكترونات فيما بينهما.
- يحتوى النيتروجين N2 الثنائي الذرات على رابطة تساهمية ثلاثية.
- يوضح الشكل التالي أنّ كل ذرة نيتروجين تشترك بثلاثة إلكترونات لتكون رابطة تساهمية ثلاثية مع ذرة نيتروجين أخرى.

الرابطة باي π - bond
- تتألف الرابطة التساهمية المتعددة من رابطة سيجما واحدة ورابطة باي واحدة على الأقل.
- يرمز للرابطة باي لها بالرمز الإغريقي π
- تتكون هذة الرابطة عندما تتداخل مستويات (p) الفرعية المتوازية تداخلاً متوازيًا وتشترك في الإلكترونات.
- وتشغل أزواج الإلكترونات المشاركة لرابطة باي المكان أو الفراغ أعلى الخط الذي يمثل مكان اتحاد الذرتين معًا وأسفله.
- الشكل التالي يوضح الروابط سيجما وباي فى جزي الإيثين
