عناصر الأقلاء Alkali Metals
- تقع فى الجدول الدورى الحديث فى يسار الجدول
- تسمى بالأقلاء لتفاعلها مع الماء مكونة محاليل قلوية.
2Na + 2H2O → 2NaOH + H2
- تضم الفلزات القلوية: الليثيوم - الصوديوم - البوتاسيوم - الروبيدوم - السيزيوم - الفرنسيوم.
- للفلزات القلوية مظهر فضي لامع.
- تكون الفلزات القلوية الصلبة لينة لدرجة يمكن قطعها بالسكين.
- لمعظم الفلزات القلوية كثافة منخفضة مقارنة بالعناصر الصلبة التابعة للمجموعات الأخرى.
فعلى سبيل المثال تكون كثافة كل من الصوديوم والليثيوم والبوتاسيوم أقل من كثافة الماء.
- للفلزات القلوية درجات انصهار منخفضة مقارنة بالفلزات الأخرى، ومنها الفضة والذهب.
عناصر الأقلاء أكثر الفلزات ليونة وأقلها فى درجة الأنصهار
- لأنها تتميز بوجود إلكترون واحد في مستوى طاقتها الخارجي مما يجعلها لينة بضعف الرابطة الفلزية من الذرات. ويجعلها أسهل فى الانصهار مما يقلل درجة حرارة الانصهار.
- الخلاصة هى أن سبب ذلك هو ضعف الرابطة الفلزية.
كيف تنشأ الرابطة الفلزية ؟
- عندما تكون ذرات الفلز قريبة من بعضها في الحالة الصلبة ، فأن كل ذرة فلز تميل لفقد إلكترون أو أكثر من إلكترونات التكافؤ في الغلاف الخارجي.
- لكن تمتاز هذه الالكترونات بأنها حرة الحركة في بلورة الفلز.
- مما يؤدي إلى تخلل إلكترونات التكافؤ ( التى تكون على شكل سحابة ) بين الأيونات الموجبة للفلز.
- تقوم هذه السحابة بتقليل قوى التنافر بين أيونات الفلز فتربطها معاً وتتكون الرابطة الفلزية في نموذج يدعى البحر الالكتروني The sea of electrons
العوامل المؤثرة على قوة الرابطة الفلزية
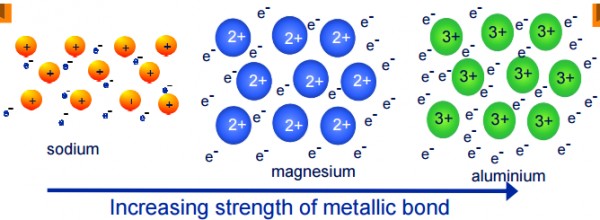
(1) عدد الالكترونات الحرة
بزيادة عدد الالكترونات الحرة الغير متمركزة تزداد قوة الجذب تزداد قوة الجذب بين الايونات الموجبة والالكترونات الحرة مما يزيد قوة الرابطة الفلزية .
(2) شحنة الكاتيون أو عدد البروتونات الموجبة
كلما زاد عدد البروتونات فى ذرة الفلز كلما زادت قوة الجذب بين الايونات الموجبة والالكترونات الحرة مما يزيد قو الرابطة الفلزية .
(3) حجم ذرة الفلز
كلما قل حجم ذرة الفلز كلما زادت قوة الجذب بين الايونات الموجبة والالكترونات الحرة مما يزيد قوة الرابطة الفلزية .