تحليل المسألة
- بما أن لديك كتلتي المادتين المتفاعلتين لذا يمكنك تعرّف المادة المحددة للتفاعل، ثم حساب كتلة الناتج.
- ويمكن معرفة عدد مولات المادة الفائضة بناءً على معرفة مولات المادة المحددة للتفاعل، وحساب عدد مولات المادة الفائضة التي تفاعلت وتحويلها إلى كتلة، ثم طرح هذه الكتلة من الكتلة المتوافرة قبل بدء التفاعل.
المعلوم والمطلوب
المعلوم: كتلة الكبريت = 200g ، كتلة الكلور= 100g
المطلوب: كتلة S2Cl2 = ؟ ، كتلة المادة الفائضة = ؟
حساب المطلوب
أولاً: حساب كتلة S2Cl2 الناتجة
(1) نكتب المعادلة الموزونة:
(S8(l) + 4Cl2(g) → 4S2Cl2(l
(2) نحسب عدد مولات المواد المتفاعلة
(أ) حساب عدد مولات S8
(الكتلة المولية لثماني الكبريت) 1mol → 256.5g
(الكتلة المستخدمة فى التفاعل) mol → 200g ??
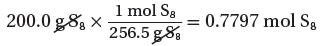
(ب) نحسب عدد مولات Cl2
(الكتلة المولية لغاز الكلور) 1mol → 70.91g
(الكتلة المستخدمة فى التفاعل) mol → 100g ??
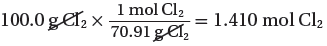
(3) احسب النسب المولية الفعلية لمولات Cl2 , S8
- احسب نسبة مولات Cl2 إلى S8
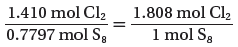
(4) حدد النسبة المولية للمواد المتفاعلة من المعادلة الموزونة:
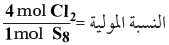
- تظهر الحسابات أن النسبة هي 1.808mol من Cl2 لكل 1mol من S8 بدلاً من 4mol من Cl2 كما تظهر المعادلة. ولذلك يكون الكلور هو المادة المحددة للتفاعل.
(5) احسب مولات S2Cl2 الناتجة من التفاعل
4mol Cl2 → 4mol S2Cl2
1.410mol Cl2 → ?? mol S2Cl2
عدد مولات S2Cl2 الناتجة من التفاعل = 1.410mol
(6) حساب كتلة S2Cl2
(الكتلة المولية للمركب) 1mol → 135g
(الكتلة الناتجة من التفاعل) 1.410mol → ??g
الكتلة الناتجة = 190.4g
ثانياً: حساب كتلة المادة الفائضة
- بما أن S8 هو المادة الفائضة فإن جزءاً منه فقط يتفاعل. لذا استخدام المادة المحددة للتفاعل Cl2 لحساب عدد مولات S8 الداخل في التفاعل وكتلته.
4mol Cl2 → 1 mol S8
1.410mol Cl2 → ?? mol S8
عدد مولات الكبريت الداخلة فى التفاعل = 0.353mol
تحويل مولات الكبريت الداخلة فى التفاعل إلى كتلة
1mol S8 → 256.5g
0.353mol S8 → ??g
كتلة الكبريت المتفاعلة = 90.41g
حساب كمية S8 الفائضة
الكمية الفائضة = كتلة المادة - الكمية التى تفاعلت
90.41g S8 - 200g S8 = 109.59g O8