الإنثالبي (المحتوى الحراري) Enthalpy
- تحدث معظم التغیرات الكیمیائیة والفیزیائیة تحت ظروف ضغط ثابت ھو الضغط الجوي. ففي المعمل مثلاً نجد أن التفاعلات عادة ما تجري في الأنابیب أو الدوارق والتي تترك مفتوحة مع محیطھا وبالتالي تتعرض لضغط ھو تقریباً الضغط الجوي.
- یعبر الكیمیائیون عن كمیة الحرارة التي تمتص أو تنبعث بواسطة عملیات عند الضغط الثابت بالأنثالبي (H) حیث أن أنثالبي التفاعل یساوي الفرق بین الأنثالبي للنواتج والأنثالبي للمتفاعلات.
- الإنثالبي ، أو المحتوى الحراري ھو "الطاقة المختزنة في مول من المادة"
- يرمز للمحتوى الحراري بالرمز (H) وھو خاصیة ممیزة للمادة (تماماً كالكتلة والحجم)، فكل مادة لھا كمیة محددة من الإنثالبي.
المحتوي الحرارى ودرجة الحرارة
- عندما تزيد درجة حرارة النظام ، تزداد طاقتى الوضع والحركة للذرات والجزيئات في النظام. وبالتالي ، تزداد الطاقة الداخلية للنظام ، مما يعني أن المحتوى الحراري يزداد - وهذا صحيح تحت ضغط ثابت أو حجم ثابت.
ΔH = ΔU + ΔPV
أولاً: المحتوى الحراري للسوائل والمواد الصلبة ودرجة الحرارة
- السعة الحرارية للنظام هي كمية الطاقة اللازمة لرفع درجة حرارة النظام بمقدار 1 درجة كلفن.
- نظرًا لأن الحرارة التي يمتصها النظام في العملية الديناميكية الحرارية هي الزيادة في المحتوى الحراري للنظام ، فإن السعة الحرارية هي مجرد التغير في المحتوى الحراري مقسومًا على التغير في درجة الحرارة.
ویمكن تعیین السعة الحراریة الجزیئیة (المولیة) عند حجم ثابت أو ضغط ثابت. فإذا سخنت المادة تحت ظروف یظل عندھا حجمھا ثابتاً، فإن السعة الحراریة الجزیئیة عند حجم ثابت (CV) یمكن التعبیر عنھا ریاضیاً كما یلي:
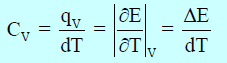
أما السعة الحراریة عند ضغط ثابت (CP) فهي تساوي:
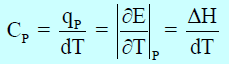
من القوانين السابقة نجد أن المحتوى الحراري يتوقف على درجة الحرارة بالكلفن (علاقة طردية)
ΔH = Cp / ΔT
ثانياً : المحتوى الحراري للغازات ودرجة الحرارة
أما بالنسبة للتفاعلات التي تشتمل على غازات، فإنه في ھذه الحالة یكون التغیر في الحجم كبیراً ولا یمكن إھماله، وبفرض أن الغاز مثالي فإن:
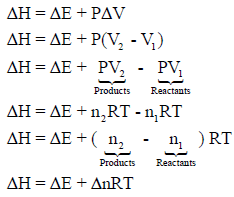
ومن القانون الأخير يتوقف المحتوى الحراري فى الغازات على درجة الحرارة فكلما زادت درجة الحرارة كلما زاد المحتوى الحراري.
الخلاصة : يزداد المحتوى الحراري بزيادة درجة الحرارة
- كما يمكنك قراءة هذا الموضوع الرائع من موقع/ تعرف على علم الكيمياء:
العوامل المؤثرة على حرارة (انثالبي) التفاعل