القانون العام للغازات The Ideal Gas Law
- يمكن جمع كل من قانون بويل وقانون شارل وقانون جاي لوساك وقانون أفوجادرو في علاقة رياضية واحدة تصنف العلاقة بين الضغط والحجم ودرجة الحرارة وعدد مولات الغاز.
- تعطى هذة الصيغة الرياضية نتائج أفضل للغازات التى تنطبق عليها افتراضات نظرية الحركة الجزيئية التى تعرف بالغازات المثالية.
- من قانون بويل: PV = K1
- من قانون شارل: V / T = K2
- من قانون جاى لوساك: P / T = K3
- من قانون أفوجادرو: V / n = K4
حيث K1 , K2 , K3 , K4 ثوابت
- من هذه القوانين الأربعة يمكن الحصول على العلاقة الرياضية الآتية:
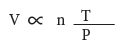
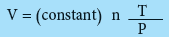
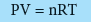
وتسمى المعادلة الأخيرة: القانون العام للغازات المثالية

وحدات قياس الثابت العام للغازات (R)
(1) القيمة العددية (R) بوحدة atm.L/mol.K
- عندما نريد ايجاد قيمة R نأخذ مول واحد من أي غاز مثالي (n = 1) في الظروف القياسية (STP)( درجة حرارة 0Co وضغط 1atm) والذي يشغل حجماً قدره 22.414L وبالتعويض في معادلة الغاز المثالي :

(2) القيمة العددية (R) بوحدة Pa.m3/mol.K
وبالإمكان استخدام الوحدات الدولية (SI) للضغط (باسكال) (101325 = Pa) والحجم يساوي 22.4 × 3-10 m3 ، وعدد المولات (n) يساوي 1mol ودرجة الحرارة تساوي 273K لايجاد قيمة R بالوحدات الدولية:
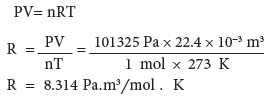
(3) القيمة العددية (R) بوحدة Pa.m3/mol.K
- بما أن Pa = Kg/m.s2 وبتعويضها فى الوحدة أعلاه نجد أن:

جدول يوضح قيم ووحدات قياس الثابت العام للغازات

تمرين محلول
أحسب عدد مولات غاز NO فى الظروف القياسية أذا كان حجمه 5.6L؟
الحل:
الظروف القياسية هي ضغط 1atm ودرجة حرارة 273K
