أولاً: قوي الترابط الجزيئية Intramolecular forces
- لو كان لجسيمات المادة جميعها عند درجة حرارة الغرفة متوسط الطاقة الحركية نفسه ، فما سبب وجود مواد غازية وأخرى صلبة أو سائلة؟ تكمن الإجابة عن هذا التساؤل في التجاذب في الجسيمات نفسها، وفيما بينها.
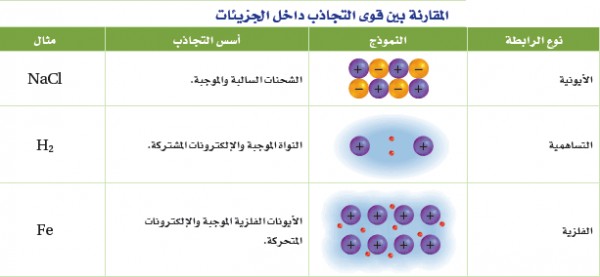
- وتسمى قوى التجاذب التي تربط بين جسيمات المادة بروابط أيونية وتساهمية وفلزية بقوى الترابط الجزيئية intramolecular forces ويعنى المقطع intra بمعنى (داخل) بينما المقطع molecular بمعنى (جزيئية) ويقصد بالجزيئية الذرات والأيونات والجزيئات.
- يوضح الجدول التالي المقارنة بين قوى التجاذب داخل الجزيئات
القوي بين الجزيئات intermolecular forces
لا تمثل قوى الترابط الجزيئية كافة قوى التجاذب بين الجسيمات بل هناك قوى تجاذب أخرى تسمى القوى بين الجزيئات intermolecular forces وهي قوى بينية تربط بين جسيمات متشابهة، مثل تلك التي بين جزيئات الماء، أو بين جسيمات مختلفة مثل ذرات الكربون في الجرافيت ، وجسيمات السليلوز في الورق.
- هناك عدة أنواع من القوى بين الجزيئات، ومنها:
(1) قوى فاندرفال Van der Waals forces وتختلف هذة القوى في قوتها ، ولكنها أضعف من قوى الربط التي تربط بين الذرات في الجزيء.
(2) القوى الضعيفة بين الجزيئات غير القطبية التي تسمى قوى التشتت London Dispersion Forces
(3) القوى بين الأطراف المشحونة بشحنات مختلفة في الجزيئات القطبية والتي تسمى قوى ثنائية القطب Dipole-Dipole Attractive Forces . وكلما زادت قطبية الجزيء زادت هذه القوى.
(4) الرابطة الهيدروجينية Hydrogen bonds : وهي أقواها،وتتكون بين ذرة هيدروجين تقع في نهاية أحد الأقطاب وذرة نيتروجين أو أكسجين أو فلور في جزيء آخر.
وعلى الرغم من اختلاف هذه القوى في قوتها بعضها عن بعض، إلا أن القوى بين الجزيئات كلها أضعف من قوى الترابط داخل الجزيئات.