التهجين
عملية خلط أو اندماج أو اتحاد بين مدارين أو أكثر للإلكترونات في نفس الذرة مختلفين. ويكونان متقاربين في الطاقة لتنتج مدارات مهجنة جديدة متكافئة>
الطريقة الأولى لمعرفة نوع التهجين لأى مركب
(1) نحدد الشكل الهندسي للمركب
- لمعرفة الأشكال الهندسية للمركبات يجب أتباع قاعدة AXnEm
حيث A : الذرة المركزية
X : الذرة المرتبطة بالذرة المركزية (الليجاند).
E : زوج الألكترونات الحر Lone Pair
n , m : هي أعداد حيث (n) : عدد الذرات المرتبطة بالذرة المركزية ، (m): عدد أزواج الألكترونات الحرة.
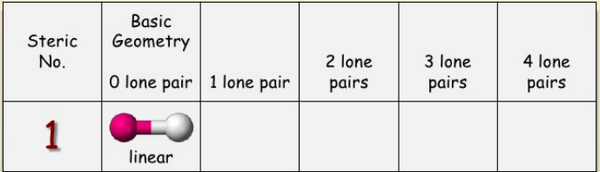
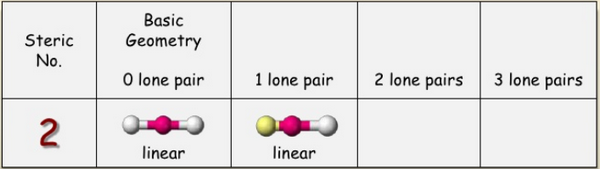
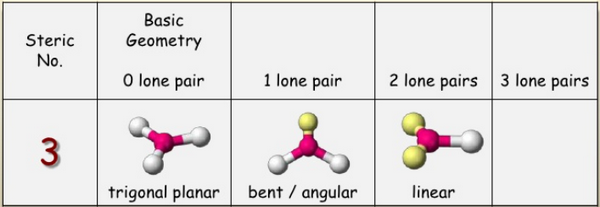
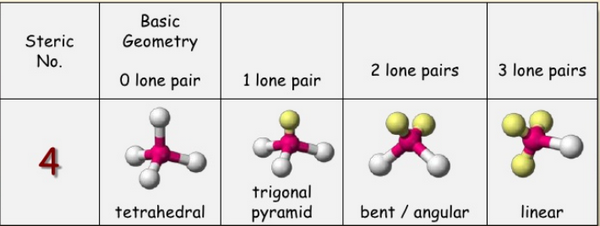
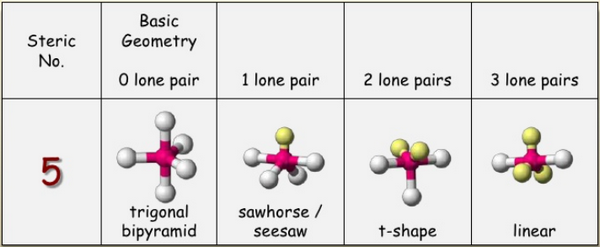
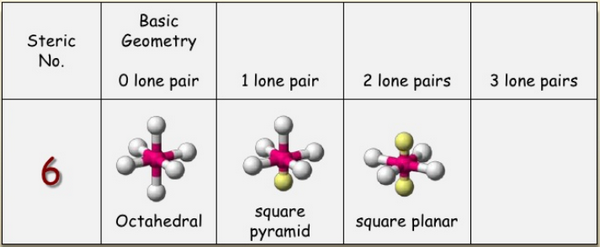
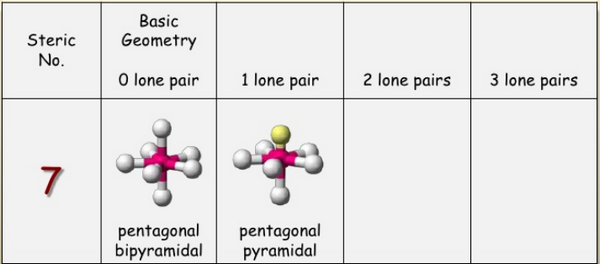
ثم أستخدم الجدوال الآتية لتحديد الشكل الهندسي : AXE Method
(2) ثم أتبع القواعد التالية:
اولاً: تهجين الذرات المركزية
(1) تهجين Sp3
- يتكون بتداخل 3 أفلاك P مع فلك S. ويتكون إذا كان شكل المركب هرم رباعي Tetrahedral أو هرم ثلاثي Trigonal pyramidal أو منحني Bent.
- أمثلة على كل نوع: الهرم الرباعي CH4 - الهرم الثلاثي NH3 - المنحني H2O.
(2) تهجين Sp2
- يتكون بتداخل فلكي P مع فلك S ، ويتكون إذا كان شكل المركب مثلث مسطح Trigonal planar
- أمثلة على هذا النوع: BF3.
(3) تهجين SP:
- يتكون بتداخل فلك P مع فلك S ، ويتكون إذا كان شكل المركب خطي Linear.
- أمثلة على هذا النوع CO2.
(4) تهجين dSp3:
- يتكون بتداخل فلك d مع 3 أفلاك P مع فلك S.
- يحدث هذا النوع إذا كان شكل المركب هرمين ثلاثيين"Trigonal Bipyramid".
- أمثلة على هذا النوع PCl5.
(5) تهجين d2Sp3:
- يتكون بتداخل فلكي d مع فلك S مع 3 أفلاك P.
- يحدث هذا النوع إذا كان شكل المركب ثمانى الأوجه"Octahedral".
- أمثلة على هذا النوع: PCl6.

ثانياً: تهجين الذرات الطرفية
-إذا كانت الذرة لا تصنع أي رابطة باي فإن تهجينها هو Sp3.
-إذا كانت الذرة تصنع رابطة باي فإن تهجينها هو Sp2.
-إذا كانت الذرة تصنع رابطتين باي فإن تهجينها Sp.
ثالثاً: تهجين الجزيئات
-إذا كان الجزيء لا يوجد فيه أي رابطة باي فإن التهجين فيه Sp3 ، مثال: Cl2
-إذا كان الجزيء يوجد فيه رابطة باي فإن التهجين فيه Sp2 ، مثال:O2
-إذا كان الحزيء يوجد فيه رابطتي باي فإن التهجين فيه Sp ، مثال:N2
الطريقة الثانية لمعرفة نوع التهجين لأى مركب
- يمكن معرفة نوع التهجين عن طريق حساب Steric number
- Steric number = عدد الذرات المرتبطة بالذرة المركزية + عدد الأزواج الحرة التى تمتلكها الذرة المركزية
- فإذا كان :
Steric number = 2 → Linear → Sp hypridization
Steric number = 3 → Trigonal planar → Sp2 hypridization
Steric number = 4 → Tetrahedral → Sp3 hypridization
Steric number = 5 → Trigonal bipyramidal → dSp3 hypridization
Steric number = 6 → Octahedral → d2Sp3 hypridization
وفى حالة وجود ازواج من الألكترونات الحرة :