الإيثرات التاجية Crown ether
- مركب كيميائي حلقي يتكون من عدة مجموعات إيثر متصلة مع بعضها البعض.
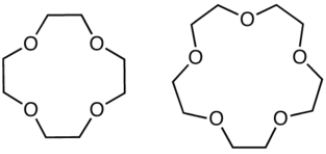
- استوحى اسم التاج من الشكل الدائري المتعرج الذي يميز الجزيئات والذي يشبه التيجان الملكية.
- اما اسم الأثير فيشير إلى المجموعة الوظيفية التى تشكل الجزئ حيث يتكون الإيثر من ذرة اكسجين مرتبطة بذرتي كربون.
- الكيميائي تشارلز بيدرسن أول من نجح فى تخليق ايثرات تاجية فعالة عام 1967م وحاز لاكتشافه هذا على جائزة نوبل في الكيمياء.
- التمثيل ثلاثى الأبعاد يظهر بوضوح أن السطح الخارجي للإيثرات التاجية غير قطبي.
تسمية الإيثرات التاجية
-تسمى الإيثرات التاجية باستخدام رقمين تتوسط بينهما كلمة تاج، حيث يشير الرقم الأول إلى عدد الذرات الكلي في الحلقة، أما الرقم الثاني فيشير إلى عدد ذرات الأكسجين.
أي كالتالي:
التسمية باللغة العربية: عدد ذرات الكربون - تاج - عدد ذرات الأكسجين.
التسمية باللغة الأنجليزية: No of Carbon atoms - Crown - No of Oxygen atom
أمثلة:

معقدات الإيثرات التاجية Crown ether Complex
- تتفاعل الإيثرات التاجية مع الإيونات الموجبة المختلفة (الكاتيونات) مثل +Na+ , K حيث تتميز الإيثرات التاجية بتجويف مركزي تمسك داخله ذرات الأكسجين بالإيون المعدنى لذلك سميت بمعقدات الأيثرات التاجية.
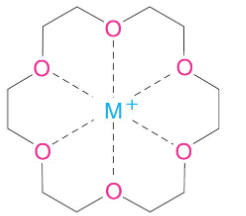
- ترتبط الإيثرات التاجية بشكل قوي مع كاتيونات محددة مشكّلةً معقدات تناسقية، تحتل فيها ذرات الأكسجين مواقع مناسبة للتناسق مع كاتيون يتوضع داخل الحلقة.
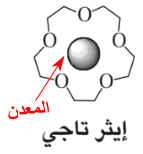
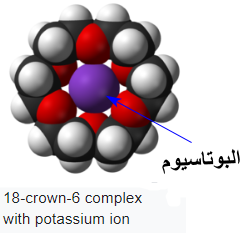
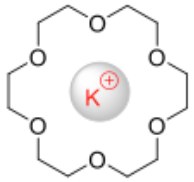
- من شروط تكوين معقدات الإيثرات التاجية هي أن يكون حجم الإيون المعدنى (الكاتيون) مناسب وملائم لبتسع في التجويف داخل الحلقة.
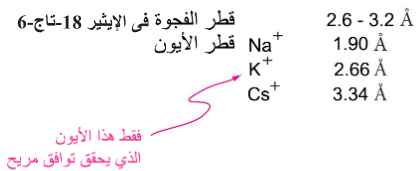
- إيثر (18-تاج-6) له ألفة عالية تجاه كاتيونات البوتاسيوم، أما إيثر (15-تاج-5) فله ألفة لكاتيونات الصوديوم، في حين أن إيثر (12-تاج-4) ألفة لكاتيونات الليثيوم.
- وبما أن ذرات الأكسجين تحتوى على إلكترونات غير رابطة وشحنتها سالبة يحدث تجاذب بين إيون الكاتيون الموجب وإلكترونات ذرة الأكسجين ذات الشحنة الجزيئية السالبة.
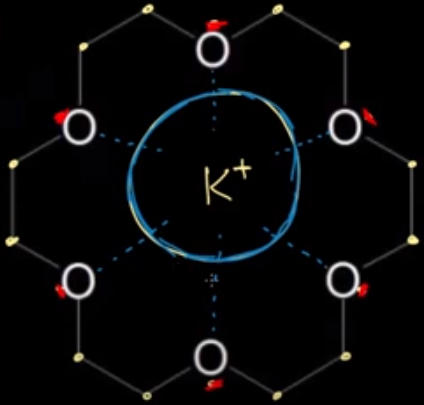
فى الشكل السابق أيون البوتاسيوم يمثل التاج والإيثر يمثل رأس الأنسان (الملك) لذلك يسمى هذا النوع بالإيثر التاجى.
أهمية الإيثرات التاجية
مركب فلوريد البوتاسيوم KF لا يذوب فى المذيبات العضوية الغير قطبية ولكن إذا تم إضافة الإيثر التاجي له ستتفاعل ذرات الأكسجين مع البوتاسيوم وبما أن السطح الخارجي للأيثر التاجي غير قطبي لذلك سيذوب فى المذيبات العضوية غير القطبية مثل البنزين.