أعداد الكم Quantum numbers
- أعطى الحل الرياضي للمعادلة الموجية لشرودنجر أربعة أعداد سميت بأعداد الكم.
- يلزم لتحديد طاقة الإلكترون في الذرات عديدة الألكترونات معرفة قيم أعداد الكم التى تصفه وعددها أربعة وهي:
(1) عدد الكم الرئيسي (n) الذي يصف بعد الألكترون عن النواة.
(2) عدد الكم الثانوي (L) الذي يصف اشكال السحابة الألكترونية للمستويات الفرعية.
(3) عدد الكم المغناطيسي (mL) الذي يصف شكل ورقم الأوربتال الذي يوجد به الإلكترون.
(4) عدد الكم المغزلي (ms) الذي يصف الدوران المغزلي للإلكترون.
أولاً/ عدد الكم الرئيسي (principle Quantum Number : (n
- هو عدد سبق أن استخدمة (بور) في تفسير طيف ذرة الهيدروجين ويرمز له بالرمز (n).
- يستخدم عدد الكم الرئيسي فى تحديد مايلي:
(1) رتبة مستويات الطاقة الرئيسية أو الأغلفة الإلكترونية وعددها في أثقل الذرات المعروفة وهلى فى الحالة المستقرة ground state تساوي (7).
(2) عدد الألكترونات (-e) التى يتشبع بها مستوى طاقة معين تساوي ضعف مربع رقم الغلاف (2n2) حيث (n) تساوي رقم الغلاف:
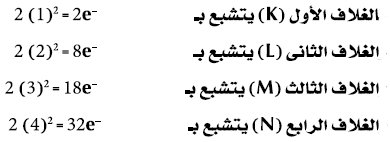
لا ينطبق هذا القانون على مستويات الطاقة الأعلى من المستوى الرابع فالمستوى الخامس مثلاً يتسع نظرياً إلى (50) إلكترون والسادس إلى (72) إلكترون وهكذا إلا أن الذرة تصبح غير مستقرة إذ زاد عدد الألكترونات أي مستوى عن (32) إلكترون.
- عدد الكم الرئيسي دائماُ عدد صحيح ويأخذ القيم 1 , 2 , 3 ,4 ........ ولا يأخذ قيمة Zero أو قيماُ غير صحيحة.
- ينقسم كل مستوى طاقة رئيسي إلى عدد من المستويات الفرعية (تحت المستويات) لها طاقة تحدد القيم التي يأخدها عدد الكم الثانوي.
ثانياً/ عدد الكم الثانوي: (Subsidary Quantum Number (l
- يتميز عدد الكم الثانوي بما يلي:
(1) يحدد مستويات الطاقة الفرعية فى كل مستوى طاقة رئيسي.
(2) المستوى الرئيسي يحتوى على عدد من مستويات الطاقة الفرعية يساوي رقمه.
(3) تأخذ المستويات الفرعية الرموز والقيم الموضحة بالجدول التالي:
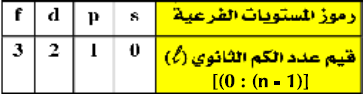
- يلاحظ اختلاف المستويات الفرعية لنفس المستوى الرئيسي عن بعضها في الطاقة اختلافاُ بسيطاُ ويمكن ترتبها حسب طاقتها كما يلي: f > d > p > s
ثالثاُ/ عدد الكم المغناطيسي (Magnetic Quantum number (ml
- يتميز عدد الكم المغناطيسي بالآتي:
(1) يمثل عدد الكم المغناطيسي عدد الأوربتالات التى يحتوى عليها مستوى فرعي معين واتجاهاتها الفراغية.
(2) يمثل بقيم عددية صحيحة فردية تتراوح مابين (l , ..... , 0 , ......., +l-)
- حيث يقابل كل قيمة من عدد الكم الثانوي (l) عدد من قيم عدد الكم المغناطيسي هي الأعداد الصحيحة الموجبة والسالبة فعندما:
l = 0 → ml = 0
(1- , l = 1 → ml = (+1 , 0
( 2- , 1- , l = 2 → ml = (+2 , +1 , 0
(3 - , 2- , 1- , l = 3 → ml = (+3 , +2 , +1 , 0
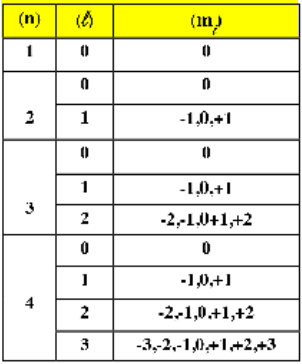
- يوضح الجدول التالي قيم عدد الكم المغناطيسي المحتملة لذرة عدد مستويات الطاقة فها أربعة (n = 4)
المستوى الفرعي (s) : عبارة عن أوربتال واحد وشكله كروي متماثل حول النواة.
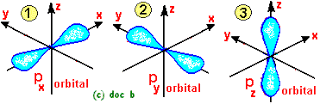
المستوى الفرعي (P):
- عبارة عن ثلاثة أوربتالات تتخذ محاورها الأتجاهات الفراغية X , Y , Z ولذا يرمز لها بالرموز Px , Py , Pzb وهي متعامدة.
- تأخذ الكثافة الألكترونية لكل أوربتال منها شكل كمثرتين متقابلتين عند الرأس dumb-bells في نقطة تنعدم فيها الكثافة الألكترونية.
المستوى الفرعي (d): عبارة عن (5) أوربتالات وتأخذ الأشكال والرموز التالية:

المستوى الفرعي (f) عبارة عن (7) اوربتالات واشكالها معقدة للغاية
- الشكل التالي يوضح أشكال الأوربتالات s , P , d , f

رابعاً/ عدد الكم المغزلي (Spin quantum Number (ms
- لا يتسع أى أوربتال لأكثر من إلكترونين يدور كل منهما حول محوره ، وذلك أثناء دورانه حول النواة.
ويمكن تخيل ذلك لو تصورنا دوران الارض حول نفسها أثناء دورانها حول الشمس.
- وبالرغم من أن إلكتروني الأوربتال الواحد يحملان نفس الشحنة السالبة فقد يتبادر إلى الذهن أنهما يتنافران ، الإ أن ما يحدث فعلاُ هو أنه نتيجة لدوران الألكترون حول محورة في إتجاه معين يتكون مجال مغناطيسي يعاكس اتجاة المجال المغناطيسي الناشي عن دوران الألكترون الآخر حول محوره. ويقال أن الإلكترون فى حالة إزدواج Paired ، ويرمز لذلك بالرمز (↑↓)
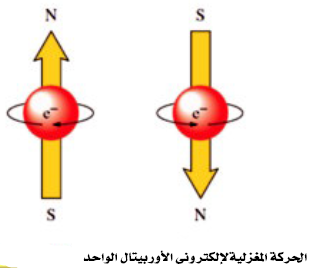
- يحدد عدد الكم المغزلي (ms) نوعية حركة الألكترون المغزلية فقد تتخذ الحركة اتجاة عقربي الساعة (↑) وتكون قيمة (ms) له (1/2+) أو عكسها (↓) وتكون قيمة (ms) له (1/2-)
أنظر الإجابة الثانية لتكملة الشرح ورؤية المصادر / المراجع عن أعداد الكم