الأحماض والقواعد
- يوجد ثلاث نظريات لتعريف الحمض والقاعدة وهي:
(1) نظرية أرهينيوس Arrhenius theory
(2) نظرية برونستند – لوري Bronsted - Lowry theory
(3) نظرية لويس Lewis theory
وسوف نشرح كلاً منهما بالتفصيل:
أولاً/ نظرية أرهينيوس Arrhenius theory
- إذا كان الماء النقي متعادلاً فكيف يصبح المحلول المائي حمضياً أو قاعدياً؟
- كان أول شخص يجيب على هذا السؤال الكيميائي السويدي سفانت أرهينيوس الذي اقترح عام 1883م ما يعرف الآن بنظرية أرهينوس للأحماض والقواعد.
الأحماض حسب نظرية أرهينوس
- الحمض هو مادة تحتوى على الهيدروجين (H) ، وتتأين في المحاليل المائية منتجة أيونات الهيدروجين (+H).
- عند إذابة غاز كلوريد الهيدروجين فى الماء تتأين جزيئات HCl مكونة أيونات (+H) التى تجعل المحلول حمضياً.
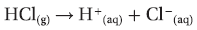
القواعد حسب نظرية أرهينوس
- القاعدة هي مادة تحتوى على الهيدروكسيد (OH) ، وتتأين في المحاليل المائية منتجة أيونات الهيدروكسيد (OH-).
- عند إذابة غاز هيدروكسيد الصوديوم فى الماء تتأين جزيئات NaOH مكونة أيونات (OH-) التى تجعل المحلول قاعدياً.
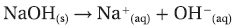
عيوب نظرية أرهينيوس
على الرغم من أن نظرية أرهينوس تفسر الكثير من المحاليل الحمضية والقاعدية ، الإ أنها لا تخلو من بعض السلبيات.
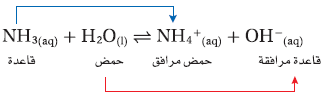
- مثلاً لا تحتوي الأمونيا NH3 ، وكربونات الصوديوم Na2CO3 على مجموعة الهيدروكسيد ، الإ أن كلاً منهما ينتج أيونات الهيدروكسيد عند إذابته فى الماء.
ثانياً/ نظرية برونستند – لوري Bronsted - Lowry theory
- اقترح الكيميائي الدنماركي يوهان برونستد والكيميائي الإنجليزي توماس لوري نظرية أشمل للأحماض والقواعد.
- تنص نظرية برونستند - لوري على أن:
" يكون الحمض هو المادة المانحة لأيون الهيدروجين ، في حين تكون القاعدة هي المادة المستقبلة لهذة الأيون".
المواد المانحة لأيون الهيدروجين والمواد المستقبله له
- إذا افترضنا أن الرمزين X , Y يمثلان عنصرين غير فلزيين أو أيونات سالبة متعددة الذرات فإننا تستطيع كتابة الصيغة العامة للحمض في صورة HX , HY.
- عندما يذوب جزئ من حمض HX فى الماء يعطي أيون +H لجزئ ماء ، فيسلك جزئ الماء سلوك القاعدة، ويكتسب أيون +H كما فى المعادلة الآتية:
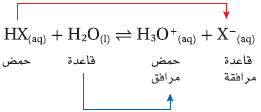
وعند اكتساب جزئ الماء أيون +H يصبح حمضاً ، فتصبح صيغته +H3O (الهيدرنيوم) ويعد حمضاً لأن لديه أيون +H أضافياً يستيطع منحه.
الأحماض والقواعد المرافقة
- الحمض المرافق (المقترن) هو المركب الكيميائي الذي ينتج عندما تستقبل القاعدة أيون الهيدروجين.
مثال: القاعدة H2O تستقبل أيون الهيدروجين من الحمض HX فيكون الحمض المرافق +H3O
- القاعدة المرافقة (المقترنة) هو المركب الكيميائي الذي ينتج عندما يمنح الحمض أيون الهيدروجين.
مثال: يمنح الحمض HX أيون الهيدروجين ويصبح القاعدة المرافقة -X
- الأزواج المترافقة من الحمض والقاعدة هي أى مادتين ترتبطان معاً عن طريق منح واستقبال أيون هيدروجين واحد.
أمثلة:

- الجدول التالي يبين بعض الأحماض الشائعة وقواعدها المرافقة

ثالثاً/ نظرية لويس Lewis theory
- لاحظ أن جميع المواد المصنفة أحماضاً وقواعد بحسب نظرية أرهينيوس تصنف أيضاً أحماضاً وقواعد بحسب نظرية برونستد - لوري.
- بعض المواد غير المصنفة بأنها قواعد بحسب نظرية أرهينيوس تصنف قواعد بحسب نظرية برونستد - لوري.
- إذن لا تندهش إذا علمت أن نظرية أخري أكثر شمولية للأحماض والقواعد أقترحها الكيميائي لويس (1875 - 1946) الذي طور أيضاً نظرية زوج الإلكترونات للترابط الكيميائي.
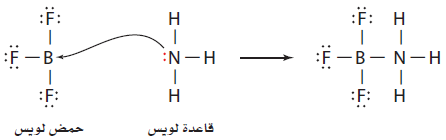
- أقترح لويس أن الحمض هو أيون أو جزئ فيه مدار ذري فارغ يستطيع أن يتقبل (يشارك) زوجاً من الألكترونات ، والقاعدة هو أيون أو جزئ له زوج إلكترونات حر (غير مرتبط) يستطيع أن يمنحه أو يشارك فيه.
- تنص نظرية لويس على أن:
حمض لويس هو مادة مستقبلة لزوج من الإلكترونات
قاعدة لويس هو مادة مانحة لزوج من الإلكترونات.
- لاحظ أن نظرية لويس تشمل جميع المواد المصنفة أحماضاً وقواعد بحسب برونستد - لوري وغيرها كثير أيضاً.
أمثلة:

ملخص النظريات الثلاث للأحماض والقواعد
