معايرة الترسيب Precipation Titrimetry
- هى المعايرة التى يتكون فيها راسب شحيح الذوبان.
- عادة فى هذا النوع من المعايرة نستخدم نترات الفضة (Silver nitrate AgNO3) كمادة معايرة (Precipitating Agent) وقدرته على التفاعل مع الهاليدات (-I- , Br- , Cl) والأيونات السالبة الشبيهة بالهاليدات (Halide-like anions) مثل (-CNO- , CN- , SCN) بحيث يكون (+Ag) معها راسب شحيح الذوبان.
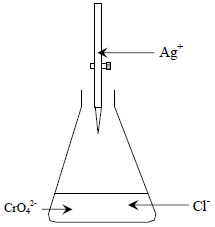
- بسبب استخدام نترات الفضة AgNO3 يطلق على هذا النوع من المعايرة (Argenometric method) (طرق القياس الفضي) حيث يكون في هذا النوع من المعايرة نترات الفضة هي المادة المعايرة بحيث أن حجمه يتغير مع مرور الوقت والمادة المعايرة وهي الهاليدات أو الأيونات الشبيهة يها تكون بالأسفل (داخل الوعاء Beaker) بحجم وتركيز معين أو العكس.
طرق تحديد نقطة النهاية في المعايرات الترسيبية
يوجد ثلاث طرق للمعايرة يستعمل فيها أيونات الفضة (طرق القياس الفضي) وتستخدم لتحديد نقطة النهاية وهذه الطرق هي:
(1) طريقة موهر Mohr's method
(2) طريقة فولهارد Volhard's method
(3) طريقة فاجان Fajan's method
طريقة موهر Mohr's method
- تعرف أيضاً بطريقة مور.
تستخدم طريقة موهر لتحديد تركيز كلاً من الأيونات التالية (-CN- , Br- , Cl) بحيث يستخدم أيون الكروميت (2-Chromate ion CrO4) ككاشف بحيث يعطي لون أحمر قرميدي (brick -red) لراسب (Ag2CrO4) المتكون بعد انتهاء كمية الأيون المراد تحليله (-CN- , Br- , Cl) حسب المعادلة التالية:
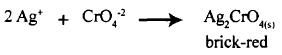
- يجب أن تحدث هذة المعايرة في وسط متعادل أو قاعدي (pH = 7-10) والسبب لأن CrO4-2 عبارة عن قاعدة مرافقة لحمض (H2CrO4) بحيث تتفاعل فى الوسط الحمضي ، وبذلك يفقد (2-CrO4) خاصيته ككاشف.
- تكون طريقة موهر بالمعايرة المباشرة (Direct Titration).
لماذا يجب أن يكون الرقم الهيدروجينى للوسط pH = 7-10 فى طريقة موهر
- فى طريقة موهر يجب أن تكون المحاليل متعادلة أو قاعدية ضعيفة نظراً لتأثير أيون الهيدروجين على أيون الكرومات طبقاً للمعادلات الآتية:
-CrO42- + H+ ↔ HCrO4
2HCrO4- ↔ H2O + Cr2O7-2
- وواضح أن التفاعل يتجه نحو اليمين كلما زاد تركيز أيون الهيدروجين وهذا بالطبع يسبب خطأ في حساب الحجوم حيث أن ثاني كرومات الفضة أكثر ذوباناً من كرومات الفضة.
- أما فى الوسط القاعدي القوي فسوف تترسب الفضة على شكل أكسيد الفضة طبقاً للمعادلة:
2Ag+ + 2OH- ↔ 2AgOH ↔ Ag2O + H2O
- ولهذا ينبغي أن يكون الرقم الهيدروجيني فى الوسط من 7 - 10 أما إذا كان الوسط حمضي فيمكن التغلب على ذلك بإضافة كمية قليلة من بيكربونات الصوديوم أو ملح البوراكس حتى يجعل تركيز أيون الهيدروجين في الحدود المناسبة.
- يمكنك قراءة هذة التجربة المعملية كتطبيق مباشر على نظرية موهر:
تعيين عيارية وتركيز كلورید الصودیوم باستخدام محلول قیاسي من نترات الفضة
مراجع ومصادر هامة عن طريقة موهر
(1) كتاب أسس الكيمياء التحليلية - سكوج مترجم معايرة الترسيب / طريقة موهر
(2) كتاب أسس الكيمياء التحليلة تأليف محمد مجدى واصل - معايرة الترسيب / طريقة موهر
(3) كتاب مفتاح الأبداع للكيمياء التحليلية معايرة الترسيب / طريقة موهر
(4) كتاب الكيمياء التحليلية الجزء الثاني - كريشكوف مترجم - معايرة الترسيب / طريقة موهر
(5) كتاب مبادي الكيمياء العملية تأليف أحمد مدحت أسلام - معايرة الترسيب / طريقة موهر
(6) كتاب Analytical Chemistry 7e by Gary D. Christian
(7) محاضرة معايرات الترسيب - طريقة موهر