عناصر المجموعة الخامسة فى الجدول الدوري
- تضم المجموعة الخامسة فى الجدول الدوري العناصر الآتية: النيتروجين - الفوسفور - الزرنيخ - الأنتيمون - البزموت.
يقل التشابه بين أفراد هذة المجموعة إلى حد ما ، خاصة بين أول أفراد هذة المجموعة وهو النيتروجين وهو لا فلز غازي وبين آخر أفراد هذة المجموعة وهو البزموت وهو عنصر فلزي.
- تتدرج الخواص بين أفراد هذة المجموعة من الفوسفور وهو لا فلز صلب إلى الزرنيخ الذي ينتمى إلى مجموعة أشباه الفلزات ويتميز بأكاسيده المترددة إلى الأنتيمون الذي تبدو فيه الصفات الفلزية أكثر من الزرنيخ إلى الالأنتيمون الذي يتصف بصفات الفلزات.
- نجد أن الخواص الكيميائية لهذة العناصر تختلف كثيراً عند الأنتقال من عنصر إلى آخر حتى أنه يمكن القول أنه لا توجد علاقة حقيقة حتى بين أى عنصرين متجاورين مثل النيتروجين والفوسفور.
- تتشابه هذه العناصر فى تكافؤها فهي أما ثلاثية التكافؤ أو خماسية التكافؤ ويحتوى المدار الخارجي فى ذراتها على خمسة إلكترونات كما يتبين من الجدول التالي:
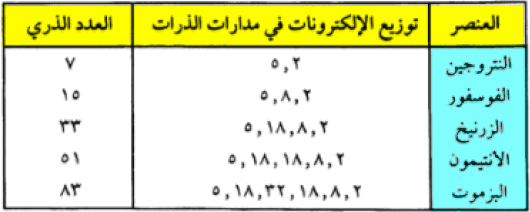
اختلافات كبيرة بين النيتروجين وعناصر باقي المجموعة
جميع عناصر هذه الزمرة تمتلك نفس الترتيب الالكتروني للغلاف الخارجي ns2 np3 بالرغم من ذلك توجد اختلافات كبيرة بين النيتروجين وعناصر باقي المجموعة وذلك للأسباب التالية:
(1) عدم احتواء الغلاف التكافؤي للنيتروجين على أوربتال من نوع (d) بعكس باقي عناصر هذه المجموعة.
(2) يستطيع النيتروجين تكوين أربع روابط فقط بينما تستطيع باقي عناصر المجموعة من خلال وجود اوربتال (d) تكوين عدد أكبر من الروابط.
(3) يمكن للنيتروجين تكوين روابط متعددة (ثنائية اوثلاثية) بينما لا تستطيع باقي عناصر المجموعة ذلك.
(4) يكون النيتروجين والفوسفور روابط تساهمية في مركباتهما أما باقي عناصر المجموعة فتميل إلى تكوين أواصر آيونية في مركباتها.
إجابة السؤال : لماذا تشكل مترابطات النيتروجين NR3 معقدات ذات مجال اضعف من المترابطات المقابلة للفوسفور والزرنيخ؟
(1) الفوسفور والزرنيخ وليس النيتروجين لها قدرة كبيرة على تكوين الروابط من خلال الأوربتال (3d).
(2) تعمل مركبات النيتروجين والفوسفور والزرنيخ ثلاثية التكافؤ R3N , R3P , R3As على شكل قواعد لويس وذلك لأن النيتروجين الفوسفور والزرنيخ لهما القدرة على منح الألكترونات للذرات المرتبطة معها ولكن الكهروإيجابية (عكس السالبية الكهربية وهى القدرة على منح الألكترونات) فى حالة الفوسفور والزرنيخ أكبر من الكهروإيجايبة فى حالة النيتروجين لذلك تكون الفوسفور والزرنيج مركبا أكثر انتشاراً من النيتروجين وتكون المركبات المعقدة التى تكونها الليجاندات R3N ذات مجال أضعف من التى تكونها الفوسفور والزرنيخ.
(3) مركبات الفوسفور والزرنيخ العضوية تستعمل بكثرة فى تحضيرات معقدات العناصر الأنتقالية باعتبارها مجاميع مانحة لزوج الألكترونات المنفردة الذى تحمله ذرة الفوسفور والزرنيخ ( أكثر منحاً للألكترونات من النيتروجين). ومن أكثر هذة المركبات شيوعاً هو ثالث الكيلات الفوسفو R3P وثالث ألكيلات الزرنيخ R3As
(4) تعتبر PR3 وليس NR3 هي ليجاندات π-acceptor أو π-acid ligands
π-acceptor ligand أو π-acid ligand عند تكوين المعقدات فأن الليجاند تمنح الالكترونات من أوربتال ممتلئ (أزواج الألكترونات) إلى أوربتال فارغ فى ذرة الفلز M وتسمى الليجاند (σ donor) وفى نفس الوقت تنتقل الألكترونات من الأوربتال (nd) في الفلز M إلى الاوربتال الفارغ π*-antibonding الموجود فى الليجاند وتسمى الليجاند π-acceptor
أى أن الليجاند هنا تعمل σ donor و π-acceptor لذلك يتم تسمية هذا النوع من الليجاندات بـ π-acceptor ligands أو π-acid ligands وتسمى هذة العملية Pi backbonding
هذا ما يحدث تماماُ فى حالة PR3 ولا يحدث فى حالة NR3 وذلك لأن NR3 تعمل على (σ donor) فقط ولا تعمل π-acceptor
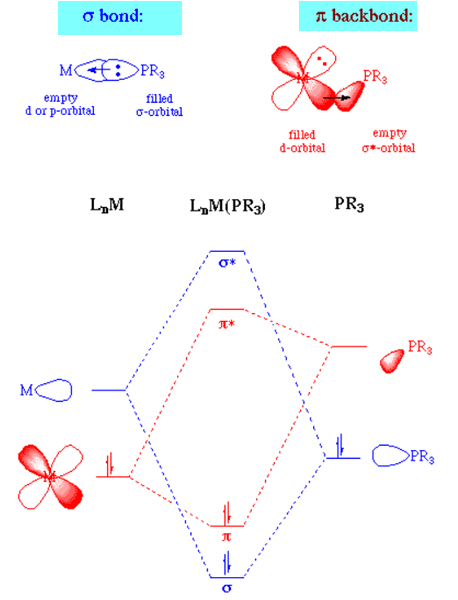
ويكون الترتيب لعناصر المجموعة الخامسة فى الجدول الدوري حسب القابيلية π-acceptor
PR3 > AsR3 > SbR3 >> NR3
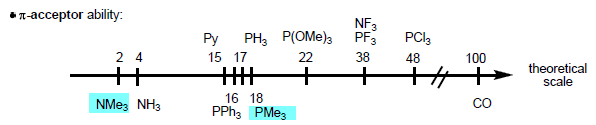
نلاحظ أن PR3 له قدرة أكبر كـ π-acceptor من NR3
(5) الخصائص الفراغية والألكترونية Steric and Electronic properties لليجاند PR3 يمكن التعديل عليها بسهولة عكس ما يحدث في NR3 حيث يكون التزاحم الفراغي كبير جداً فى حالة NR3 بسبب صغر ذرة النيتروجين.