قواعد رسم تركيب لويس للأيونات المتعددة الذرات
(1) توقع موقع ذرات معينة.
- تكون الذرة التي لها أقل جذب للإلكترونات المشتركة هي الذرة المركزية في الجزيء. ويكون هذا العنصر أقرب إلى الجهة اليسرى من الجدول الدوري.
- وفي الغالب يكون مكان الذرة المركزية فى مركز الجزئ، كما أنه يحيط بها أكبر عدد من الذرات في الجزئ. وعليه فإن باقي الذرات في الجزئ هي ذرات جانبية.
- يكون الهيدروجين دائماُ ذرة جانبية؛ لأنه يشارك بإلكترون واحد من الإلكترونات، ويتصل بذرة واحدة فقط.
(2) حدد عدد الإلكترونات المتوافرة لتكوين روابط
- ولإيجاد العدد الكلي لإلكترونات التكافؤ نجد أولاً العدد المتوافر لدى الذرات الموجودة في الأيون، ثم نطرح شحنة الأيون إن كان موجباً أو نجمع شحنته أن كان سالباً.
(3) حدد عدد أزواج إلكترونات الربط
ولتحديد هذا العدد اقسم عدد الإلكترونات المتوافرة للربط على (2)
(4) حدد أماكن أزواج الربط.
ضع زوج ترابط واحدًا (رابطة واحدة) بين الذرة المركزية وكل ذرة جانبية.
(5) حدد عدد أزواج إلكترونات الترابط المتبقية
- لتحديد ذلك اطرح عدد الأزواج المستخدمة فى الخطوة الرابعة من العدد الكلي للأزواج في الخطوة الثالثة.
- حيث تبين الأزواج المتبقية عدد الأزواج غير المترابطة والأزواج المستخدمة في الروابط الثنائية والثلاثية.
- ثم ضع الأزواج غير المترابطة حول كل ذرة جانبية (ماعدا الهيدروجين) مرتبطة مع الذرة المركزية لتحقق القاعدة الثمانية
- ثم ضع أى أزواج إضافية على الذرة المركزية.
(6) حدد ما إذا كانت الذرة المركزية تحقق القاعدة الثمانية.
هل الذرة المركزية محاطة بإربعة أزواج من الألكترونات؟ إذا كان الجواب لا فأنها لا تحقق القاعدة الثمانية.
- لتحقيق القاعدة الثمانية حول زوجاُ أو زوجين من الأزواج غير المترابطة في الذرات الجانبية إلى رابطة ثنائية أو ثلاثية بين الذرة الجانبية والذرة المركزية، فتبقى هذه الأزواج مرتبطة مع الذرة الجانبية، وكذلك مع الذرة المركزية.
- تذكّر أن الكربون والنيتروجين والأكسجين والكبريت عادة ما تكوّن روابط ثنائية وثلاثية.
رسم تركيب لويس لأيونات النيتريت -NO2
(1) أيون النيتريت يحتوي على ذرة النيتروجين وذرتين من الأكسجين وشحنة سالبة واحدة.
ولأن النيتروجين أقل قوة جذب للإلكترونات المشتركة تصبح ذرة النيتروجين هي الذرة المركزية، وذرتين الأكسجين هي الذرات الجانبية.
(2) أوجد العدد الكلي لإلكترونات التكافؤ المتوافرة للترابط
من التوزيع الألكترونى نجد أن عدد إلكترونات التكافؤ فى النيتروجين هي (5) وفى الأكسجين هي (6)
N7 : 2 , 5
O8 : 2 , 6
العدد الكلي لإلكترونات التكافؤ = النيتروجين ( 1*5) + الأكسجين ( 2*6) + (1) ألكترون واحد من الشحنة السالبة = 18 إلكترون تكافؤ
(3) حدد العدد الكلي لأزواج الترابط
العدد الكلى لأزواج الترابط = العدد الكلي لالكترونات الترابط / 2
18/2 = 9 أزواج
يتوافر 9 أزواج من الألكترونات للترابط
(4) ارسم رابطة أحادية بين ذرة (N) المركزية وذرتين الأكسجين (O) الجانبية.
O - N - O
(5) حدد عدد الأزواج غير المرتبطة المتبقية.
اطرح عدد الأزواج المستخدمة في هذه الروابط من العدد الإجمالي للألكترونات المتوافرة للترابط
9 أزواج (المجموع الكلي) – 2 أزواج مستخدمة = 7 أزواج غير رابطة
(6) أضف ثلاث أزواج غير مرتبطة إلى كل ذرة أكسجين جانبية
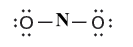
(7) اطرح الأزواج غير المرتبطة من الأزواج المتوافرة المتبقية.
7 أزواج (المجموع الكلي) – 6 أزواج مستخدمة = 1 أزواج غير رابطة
هذا الزوج الغير رابط يوضع على ذرة النيتروجين.
(8) استخدم زوجًا غير مرتبط من أحدى ذرتين أكسجين لتكوين رابطة ثنائية مع ذرة النيتروجين
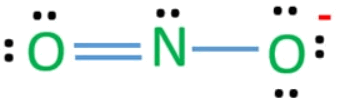
تتكون شحنة سالبة على أحد ذرات الأكسجين لأنها ثنائية التكافؤ ولكنها ترتبط بذرة واحدة من النيتروجين