القانون المستخدم فى معايرة الأحماض والقواعد
- يستخدم القانون التالي فى حسابات معايرة الأحماض والقواعد
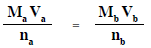
Ma = تركيز الحمض المستخدم (mol/L)
Va = حجم الحمض المستخدم فى المعايرة (ml)
na = عدد المولات من الحمض فى معادلة التفاعل المتزنة
Mb = تركيز القاعدة المستخدم (mol/L)
Vb = حجم القاعدة المستخدم فى المعايرة (ml)
nb = عدد المولات من القاعدة فى معادلة التفاعل المتزنة
حل المسألة:
أضيف 15 مل من محلول حمض الفسفوريك إلى 38.5 مل من محلول هيدروكسيد الصوديوم بتركيز 0.15 مول/لتر.
احسب تركيز محلول حمض الفسفوريك إذا حدث التفاعل طبقاً للتفاعل التالي:
الحل:

حمض الفوسفوريك H3PO4 يكون:
Ma = ?? mol/L
Va = 15 ml
na = 1
قاعدة هيدروكسيد الصوديوم يكون:
Mb = 0.15 mol/L
Vb = 38.5 ml
nb = 1
وبالتعويض فى المعادلة أعلاه يكون:
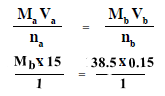
Ma = 0.385 mole/ L
مولارية حمض الفوسفوريك هو 0.385 مول/ لتر
حل آخر
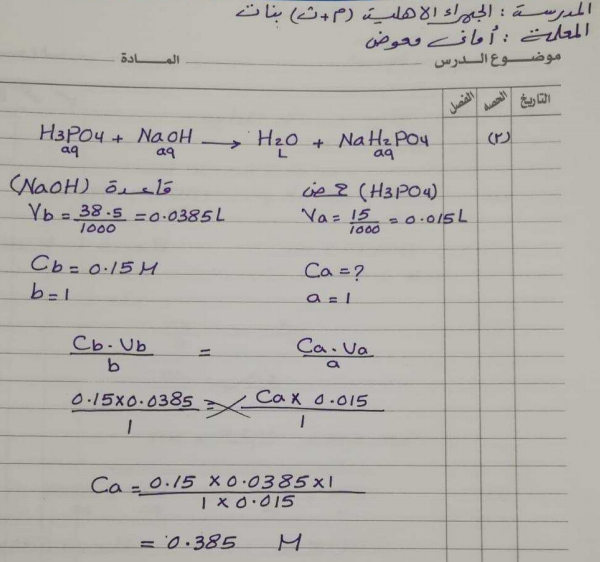
ملاحظة على المسألة : كان لابد أن يذكر كلمة معايرة أو تعادل حتى يمكن استخدام القوانين السابقة