الأيون المزدوج Zwitterions فى الأحماض الأمينية
- يرجع معظم خواص الأحماض الأمينية إلى وجود الأيون المزدوج Zwitterions
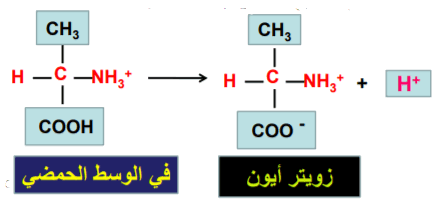
- الأيون المزدوج هو شكل الحمض الأميني الناتج عن منح مجموعة الكربوكسيل فيه بروتونها لمجموعة الأمين.
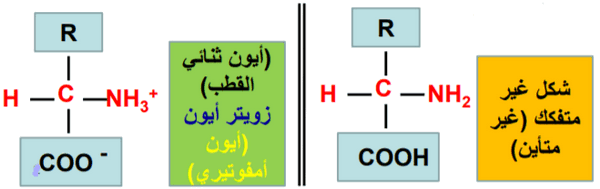
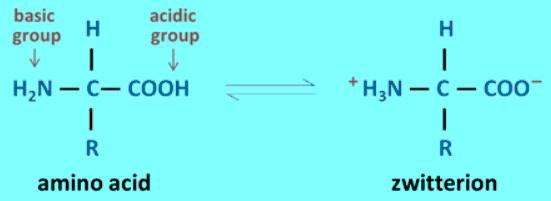
- وبناء على ذلك وجود هذا الآيون المزدوج فإن:
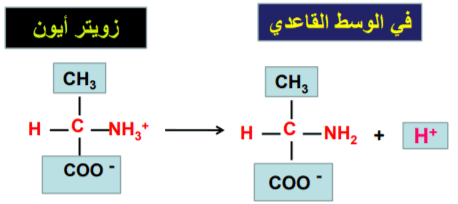
(1) الحمض الأميني يسلك كحمض في الوسط القاعدي نظرا لأن الوسط القاعدي يمتلك القدرة على انتزاع البروتون من الحمض الأميني وبالنتيجة يفقد الحمض الأميني بروتونا وبذلك فهو يتصرف كحمض،
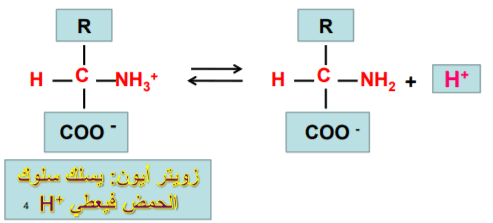
(2) الحمض الأميني يسلك كقاعدة في الوسط الحمضي لأن الوسط الحمضي يمتلك القدرة على منح بروتون للحمض الأميني نظراً لوجود أيونات الهيدروجين بتركيز كاف في الوسط الحمضي.
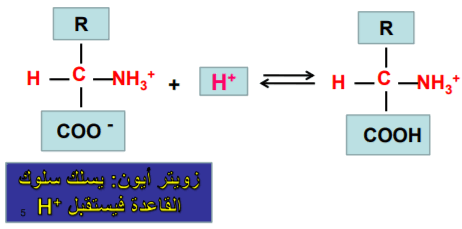
(3) في الوسط المتعادل فإن الحمض الأميني يكون متعادلا.
تتميز الأحماض الأمينية نتيجة لوجود الصورة القطبية (الأيون المزدوج) بالخواص الآتية:
(1) تذوب في السوائل القطبية كالماء ولا تذوب في السوائل غير القطبية كالبنزين والطولوين.
(2) لها خواص امفوتيرية نتيجة لوجود مجموعة حمضية NH3+ تتفاعل مع القلويات ومجموعة قلوية -COO تتفاعل مع الأحماض.
معايرة الأحماض الأمينية
معايرة الأحماض الأمينية عملية تهدف إلى معرفة الأشكال التأينية لحمض أميني ما من خلال تغيير الرقم الهيدروجيني (pH) و يتم ذلك عبر طريقتين:
- تتبع منحنى تفكك الحمض الأميني (مشبع مسبقا) بالإضافة التدريجية لقاعدة محددة.
- تتبع منحنى تشبع الحمض الأميني (مفكك مسبقا) بالإضافة التدريجية لحمض ما.
شرح منحنى معايرة الألانين Alanine Titration
- الحامض الأميني ثنائي البروتون عندما يكون مشبعا تماما بالبروتونات ( أي أن مجموعة الكربوكسيل ومجموعة الأمين مشبعتا بالبروتونات ) في هذه الحالة يستطيع هذا الحامض الأميني وهب بروتونين خلال المعايرة التامة مع القاعدة .
- ويمكن أن يعبر عن هذا النمط من المعايرة (ثنائية المرحلة) و التي مع هيروكسيد الصوديوم, بالمعادلات الآتية المشيرة إلى الطبيعة الأيونية للأنواع المشاركة.
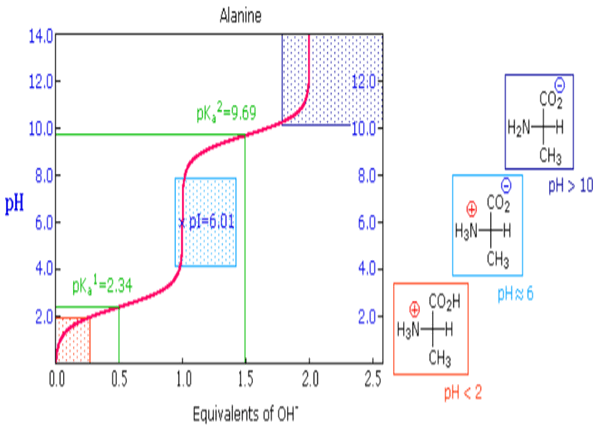
- يبين الشكل التالي منحنى المعايرة للـ Ala الذي له مرحلتان متميزتان مطابقتان لمرحلتان معايرة البروتونين من الأنواع المشبعة بالبروتونات.
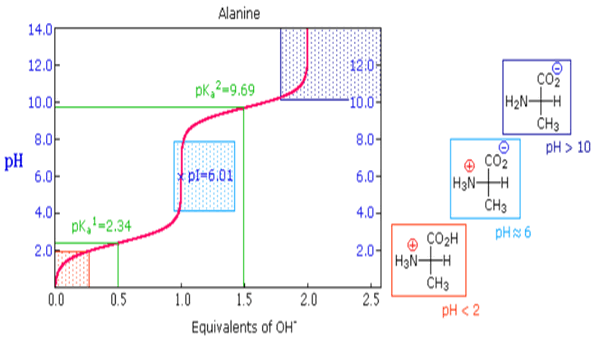
- في كل مرحلة من مرحلتي فقد البروتونات من الحمض الأميني و الموضحة في المنحنى أعلاه في منطقتي ذات التغيرشبه الأفقي في قيمة الـ pH (والتي تعتبر منطقة محلول منظم) توجد نقطة وسطية يكون عندها الرقم الهيدروجيني مساوياً للـ pK للجزيء المعاير الذي فقد بروتون.
- فى المرحلة الأولى فى المنحنى عند pH= 2.34 تمثل إزالة البروتون من الجزئ +NH3 وعند تلك القيمة من pH=2.34 يكون هناك تراكيز متكافئة من المركبين (1) ، (2)

- عند pH = 9.69 يكون هناك تراكيز متكافئة من المركبين (1) , (2)

- وبالتالي يمكن تمثيل المنحنى كالتالي:
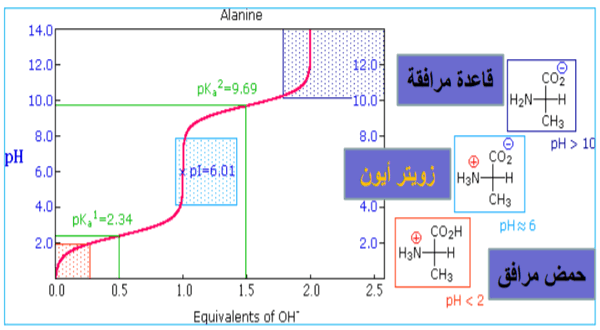
نقطة التعادل الكهربي Isoelectric point
هى قيمة pH التى تعطي حمض أمينى متعادل الشحنة الكهربائية.
نقطة التعادل الكهربي = متوسط مجموع pka للجزئ أذا كان يحتوى على COOH واحدة، NH2 واحدة

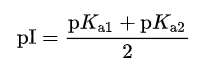
وفى منحنى معايرة الألانين يكون pKa1 = 2.34 , pKa2 =9.69 وبالتعويض فى المعادلة أعلاه نجد أن pI = 6.02
(1)عندما يكون pI < pH فأن الجزئ يكون مشحون بشحنة سالبة.
(1) وإذا كان pI > pH فأن الجزئ يكون مشحون بشحنة موجبة.
(3) تكون الشحنات الموجبة والسالبة متعادلة عند نقطة التعادل الكهربي pI
منحنى المعايرة للأحماض الأمينية
- أن منحنى المعايرة لجميع الأحماض الأمينية التي تحتوي على مجموعة أمين – ألفا – واحدة ومجموعة كربوكسيل – ألفا – واحدة وليس لها مجموعات متأينة أخرى في السلسلة الجانبية (R) يكون مشابهاُ تماماً لمنحنى المعايرة للألنين.
- تتميز هذة المجموعة الحاوية على Val , Iso, leu , ala ،Gly ,Phe , Leu
(1) قيم شبة متساوية للـ pKa1 والمساوية تقريباُ لـ 2.2
(1) قيم شبة متساوية للـ pKa2 والمساوية تقريباُ لـ 9.7
- الأحماض الأمينية التي لها مجاميع R قابلة للتأين لها منحنيات معايرة معقدة حيث أن منحنى المعايرة يتكون من 3 مراحل, هذه المراحل الثلاثة تمثل تفكك المجموعات الثلاثة الوظيفية الموجودة في الحمض الأميني حيث تتداخل المرحلة الثالثة إلى حد معين مع المراحل الأخرى.