تفاعلات التأكسد والأختزال
- الجدول التالي يوضح تعاريف الأكسدة والأختزال:
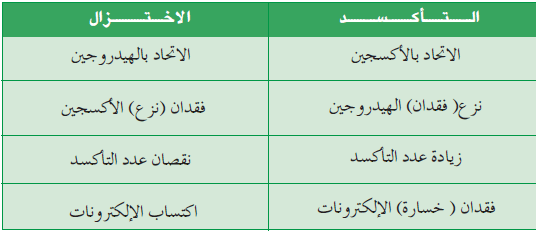
- العامل المؤكسد هو المادة التى هو المادة التى تحتوي على عنصر ينقص عدد تأكسده (يحدث له اختزال).
- العامل المختزل هو المادة التى تحتوي على عنصر يزداد عدد تأكسده (يحدث له أكسدة).
تفاعل الصوديوم والكلور كمثال لتفاعلات الأكسدة والأختزال
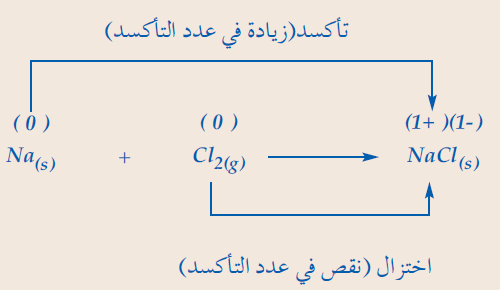
- يتفاعل الصوديوم مع الكلور مكوناُ كلوريد الصوديوم كما فى المعادلة التالية:

- لاحظ أن الصوديوم عندما يتحول من ذرة Na ألى أيون صوديوم +Na يفقد إلكتروناً أى يحدث له تأكسد.
- وعندما يتحول الكلور من ذرات كلور فى جزئ الكلور إلى أيون كلوريد -Cl فأنه يكتسب إلكتروناً أى يحدث له اختزال.
- الصوديوم حدث له أكسدة فهو عامل مختزل والكلور حدث له أختزال فهو عامل مؤكسد.
مثال آخر للتوضيح:

هل من الممكن حدوث أكسدة وأختزال فى المركبات الأيونية
- عموماُ لا تحدث الأكسدة والأختزال الإ إذا حدث تغير فى أعداد التأكسد.
- فى التفاعلات الآتية فى مركب كلوريد الصوديوم وهو من المركبات الآيونية:
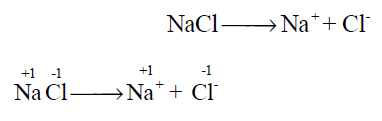
وبذلك فإن عدد الأكسدة لم يتغير مما يعني أن التفاعل السابق ليس تفاعل أكسدة واختزال.
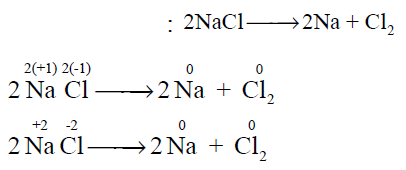
- نلاحظ أن عدد الأكسدة للصوديوم للذرة الواحدة تغير بالنقصان من (+1) إلى (0) مما يعنى أن الصوديوم تأكسد
- وبالمقابل فإن الكلور تغير عدد الأكسدة بالزيادة من (-1) إلى (0) مما يعنى أن الكلور حدث له اختزال.
- وبالتالي فإن التفاعل السابق تفاعل أكسدة واختزال.
الخلاصة هى أن تعدك من الروابط سواءاُ آيونية أو تساهمية أو غيرها وتركز على أعداد التأكسد.