السالبية الكهربية Electronegativity
- السالبية الكهربية هي قدرة الذرة على جذب إلكترونات الرابطة الكيميائية ويرمز لها بالرمز (X)
- الفلور يعتبر أكبر العناصر سالبية كهربية.
- الفرق فى السالبية الكهربية للعناصر له دور فى تحديد نوع الرابطة بين الذرات.
- الفلزات لها أقل سالبية لكبر نصف قطرها.
- اللافلزات لها أكبر سالبية لصغر نصف قطرها.
- تعتمد السالبية الكهربية على الحجم الذري فالذرة الأصغر حجماً تكون الأعلى فى السالبية الكهربية .
- العناصر ذات السالبية الكهربائية الأعلى في الجدول الدوري هي النيتروجين و الأكسجين و الهالوجينات (عناصر المجموعة 17).
- العناصر ذات السالبية الكهربائية الأقل في الجدول الدوري هي الفلزات القلوية (مجموعة 1) و الفلزات القلوية الأرضية (مجموعة 2).
- الغازات النبيلة بعضها لا يمكن تعيين السالبية الكهربائية له لأنه لا يكون مركبات،وعندما يكون الغاز النبيل مركبات تكون سالبيته الكهربائية عالية جداً و مشابهة لقيمة السالبية الكهربائية للهالوجينات.
- تترواح قيم الكهروسالبية للعناصر بين 0.7 و 3.98 ووحدتها باولنج نسبة إلى العالم الأمريكي باولنج Pauling (1994 - 1901 فالفلور أكثر العناصر كهروسالبية بقيمة 3.98. في حين أن السيزيوم والفرانسيوم أقل العناصر كهروسالبية بقيم 0.7 و 0.79 على الترتيب.
- يكون للذرة ذات الكهروسالبية الكبري قوة جذب أكبر لإلكترونات الرابطة.
تدرج السالبية الكهربية فى الجدول الدورى
فى الدورات الأفقية
تزداد السالبية الكهربية إذا اتجهنا من اليسار إلى اليمين أى بزيادة العدد الذرى ونقص نصف القطر وهذا يؤدى إلى زيادة قوة جذب النواة لإلكترونات الرابطة.
فى المجموعات الرأسية
تقل السالبية الكهربية من أعلى إلى أسفل أى بزيادة العدد الذرى وزيادة نصف القطر وهذا يؤدى إلى نقص قوة جذب النواة لإلكترونات الرابطة.
الجدول التالي يوضح السالبية الكهربية لعناصر الجدول الدوري:
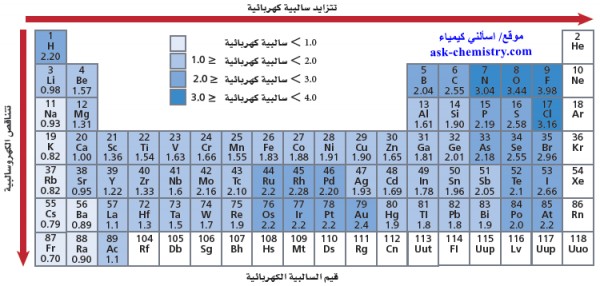
قيم الكهروسالبية Electronegativity
- يوضح الجدول الدورى التالى قيم الكهروسالبية للعناصر
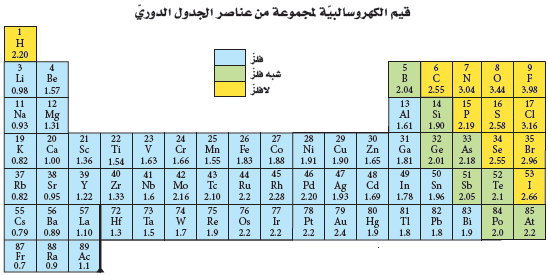
- تحسب قيم الكهروسالبية بمقارنة قوة جذب الذرة للإلكترونات المشتركة إلى قوة جذب ذرة الفلور لهذة الإلكترونات.
لاحظ أن مقادير الكهروسالبية لسلسلتي اللانثانيدات والأكتينيدات غير ظاهرة في الجدول لكنها تتراوح ما بين 1.12 - 1.7
- لاحظ أن للفلور (F) أعلى قيمة للكهروسالبية 3.98 في حين أن للفرانسيوم أقل قيمة 0.7
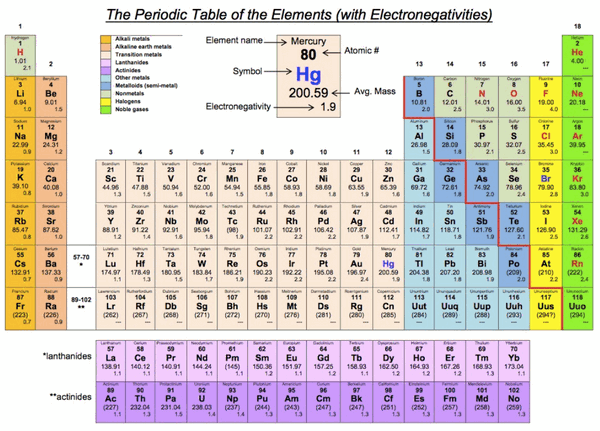
- ولأن الغازات النبيلة لا تتفاعل في الغالب، ولا تميل إلى تكوين مركبات -إلا في حالات نادرة- لذا لا يتضمن الجدول قيم الكهروسالبية للهيليوم والنيون والأرجون. ومع ذلك تتحد الغازات النبيلة الكبيرة -ومنها الزينون- مع الذرات التي لها قيم كهروسالبية عالية مثل الفلور.
- يمكنك مراجعة هذا الموضوع : كيف تم حساب أرقام السالبية الكهربية في مقياس باولينج؟
إجابة السؤال
- كما ترى من قيم الكهروسالبية للعناصر أعلاه فى الجدول الدوري ، لا يوجد اتجاه شامل لتحديد أكثر / أقل العناصر كهروسالبية التى توجد فى دورتين مختلفين أو مجموعتين مختلفتين غير متتالتين مثل النيتروجين والكبريت. بدلاً من ذلك يتم استخدام مقارنة قيم الكهروسالبية النسبية للعناصر في نفس الدورة أو نفس المجموعة كما تم ذكره أعلاه.
- أعلى العناصر كهروسالبية فى الجدول الدوري هي: الفلور - الأكسجين - الكلور - النيتروجين بالترتيب
- الخلاصة لا توجد قاعدة سحرية لمعرفة ذلك بل يتم التكهن فقط بعد معرفة أرقام السالبية الكهربية من الجدوال السابقة.