الأحماض القوية Strong Acids
- هي الأحماض تامة التأين أى أن جميع جزيئاتها تتاين فى المحلول إلى أيونات.
- محاليل الأحماض القوية توصل التيار الكهربائي بدرجة كبيرة نسبياً بسبب احتوائها على كمية كبيرة من الأيونات لذلك تعتبر إلكتروليتات قوية.
- أمثلة على الأحماض القوية: حمض الهيدرويوديك HI - حمض البيروكلوريك HClO4 - حمض الهيدروكلوريك HCl - حمض الكبريتيك H2SO4 - حمض النيتريك HNO3
-HCl + H2O → H3O+ + Cl
الأحماض الضعيفة Weak Acids
- هي الأحماض غير تامة التأين بمعنى أن جزءاً ضئيلاً من الجزيئات يتفكك إلى أيونات.
- محاليل الأحماض الضعيفة توصل التيار الكهربي بدرجة ضعيفة بسبب احتوائها على كمية صغيرة من الأيونات لذلك تعتبر إلكتروليتات ضعيفة.
- مثال: حمض الأسيتيك (الخل) CH3COOH الذي يتأين فى الماء ويعطي أيون الهيدرونيوم وأنيون الأسيتات.
+CH3COOH + H2O ↔ CH3COO- + H3O
الشكل التالي يوضح التوصيل الكهربي للاحماض القوية والضعيفة

- الشكل التالي يوضح القوى النسبية لبعض الأحماض والقواعد الشائعة
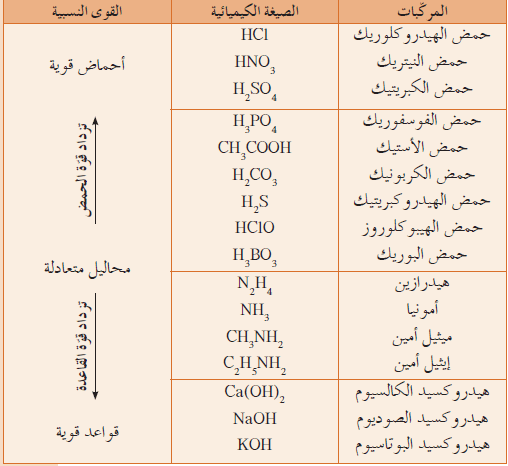
ملاحظة هامة:
لا توجد علاقة بين قوة الحمض وعدد ذرات الهيدروجين فى تركيبة الجزيئي فحمض الفوسفوريك H3PO4 يحتوى الجزئ منه على ثلاث ذرات هيدروجين ومع ذلك هو حمض أضعف من حمض النيتريك الذي يحتوى على ذرة هيدروجين واحدة.