القانون المستخدم فى معايرة الأحماض والقواعد
- يستخدم القانون التالي فى حسابات معايرة الأحماض والقواعد
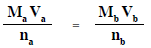
Ma = تركيز الحمض المستخدم (mol/L)
Va = حجم الحمض المستخدم فى المعايرة (ml)
na = عدد المولات من الحمض فى معادلة التفاعل المتزنة
Mb = تركيز القاعدة المستخدم (mol/L)
Vb = حجم القاعدة المستخدم فى المعايرة (ml)
nb = عدد المولات من القاعدة فى معادلة التفاعل المتزنة
حل المسألة
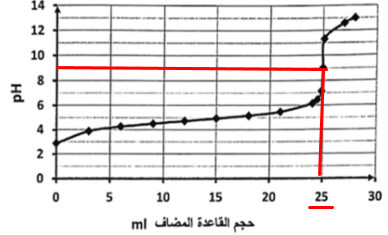
من الرسم نلاحظ أن :
(1) المنحنى المرسوم فى السؤال هو منحنى معايرة حمض قوي مع قاعدة قوية لذلك يمكن التعبير عن الحمض القوي أحادي البروتون بالرمز HA مثلاً
وتكون معادلة التفاعل كالتالي:
HA + KOH → KA + H2O
(2) بما أن نقطة التعادل تم الحصول عليها عند pH = 9 لذا يكون حمض القاعدة المضاف هو 25 مل (من الرسم)
حمض HA يكون:
Ma = ?? M
Va = 50 ml
na = 1
قاعدة هيدروكسيد البوتاسيوم يكون:
Mb = 0.2 M
Vb = 25 ml
nb = 1
وبالتعويض فى المعادلة أعلاه يكون:
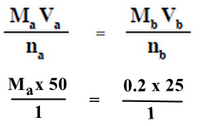
Ma = 0.1 M
تركيز الحمض = 0.1 مولار (مول/لتر).