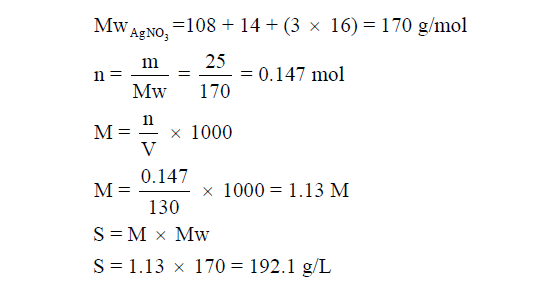قوة المحلول (Strength (S
– هي عدد الجرامات المذابة الموجودة في لتر من المحلول.
– ويمكن صياغتها رياضياً بالقانون:
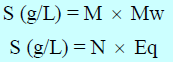
حيث :
S = قوة المحلول بوحدة g/L
Mw = الوزن الجزيئي للمادة (الكتلة المولية)
Eq = الوزن المكافئ للمادة
M = المولارية
N = العيارية
أمثلة محلولة على قانون قوة المحلول (S)
مثال (1): محلول هيدروكسيد الصوديوم NaOH عياريته 0.2 N فاحسب قوة المحلول (S)؟ علماً بأن الكتل الذرية : (H = 1, O = 16, Na = 23)
الحل :
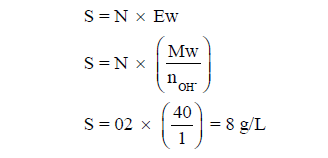
مثال (2): محلول حمض الكبريتيك H2SO4 تركيزه 0.5 M فاحسب قوة المحلول (S)؟ علماً بأن الكتل الذرية : (H = 1, O = 16, S = 32)
الحل :
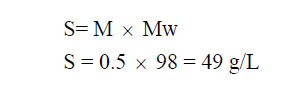
مثال (3): إذا أذيب 25g من نترات الفضة AgNO3 في 150g من الماء، فإذا أصبح حجم المحلول 130ml ، فاحسب قوة المحلول (S)؟ علماً بأن الكتل الذرية : (N = 14, O = 16, Na = 108)
الحل :