نظرية برونستد - لوري للأحماض والقواعد
- في عام 1923 وضع الدنماركي جونز برونشتد والأنجليزى توماس لوري نظريتهما عن الحمض والقاعدة.
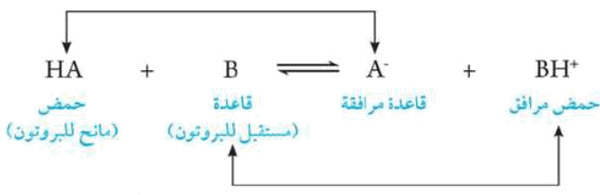
- وقد تم تعريف الحمض والقاعدة كالتالي:

وهذا معناه أن يكون اتحاد الحمض والقاعدة هو أن الحمض أى مادة تعطى البروتون والقاعدة هى أى مادة تستقبل البروتون أى أن التفاعل هو انتقال للبروتون من الحمض إلى القاعدة.
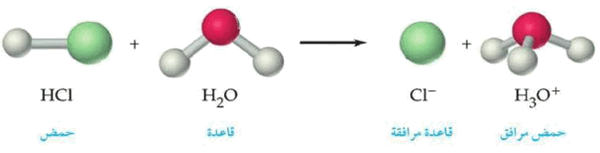
- عند إذابة حمض HCl فى الماء يعتبر HCl حمضاً لأنه يمنح بروتوناً إلى الماء وبالتالي يعتبر الماء قاعدة لأنه يكتسب هذا البروتون ويصبح أيون الكلوريد -Cl قاعدة مرافقة بينما أيون الهيدرونيوم +H3O حمض مرافق.
كما أن التعريف يسمح لنا باعتبار الأمونيا (النشادر) قاعدة والماء حمض كالتالي:

فعندما يمنح الحمض بروتوناً يتحول إلى قاعدة وعندما تكتسب القاعدة هذا البروتون تتحول إلى حمض

الأمينات قواعد
- أن زوج الإلكترونات غير الرابط على ذرة النيتروجين هو المتحكم في معظم الخواص الكيميائية للأمينات لأنه يعمل كقاعدة وكنيوكلوفيل.
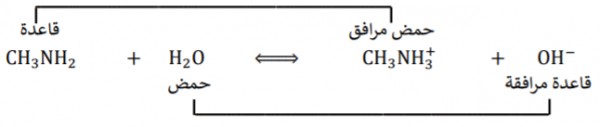
- وعليه فأن CH3NH2 يسلك سلوك القواعد لأنه عندما يدخل فى التفاعلات يكون جاهزاً لأستقبال البروتون
- فى التفاعلات الآتية :
+CH3NH2 + H2O ↔ OH- + CH3NH3
+CH3NH2 + HCl ↔ Cl- + CH3NH3
فى كلا التفاعلين نجد أن CH3NH2 يتفاعل كقاعدة برونستد (يستقبل البروتون) وعليه يكون +CH3NH3 حمض مرافق.