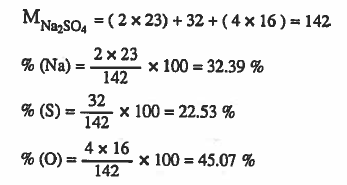قانون النسب الثابتة Low of Definite Proportion
تعريف قانون النسب الثابتة
- ينص القانون على أن: " كل مركب كيميائي مهما اختلفت طرق تحضيره ، فإنه يتركب من عناصره نفسها متحدة مع بعضها بنسب وزنية ثابتة".
توضيح لقانون النسب الثابتة
بالنسبة للماء ( H2O) تكون نسبة الهيدروجين في الماء % 11.11 ، نسبة الأكسجين في الماء % 88.89 ، وهذه النسب ثابتة لا تتغير بتغير المكان أو الزمان أو الظروف.
- يمكن حل هذا النوع من المسائل بالطرق التالية:
أولاً/ الطريقة الأولى لحل مسائل قانون النسب الثابتة
يمكن إيجاد النسبة المئوية باستخدام وزن العنصر ووزن المركب بالجرام حسب القانون التالي:
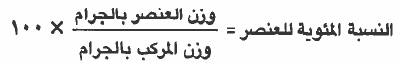
مثال (1): عينة من الماء وزنها (10g) فإذا كان وزن الهيدروجين في هذه العينة ( 1.11g) احسب نسبة كل من الأوكسجين والهيدروجين في هذه العينة؟

مثال (2): إذا كان لدينا (60g) من هيدروكسيد الصوديوم ، حـيـث كـانت نسبة الاكسجين (%40) احسب وزن الأكسجين.

ثانياً/ الطريقة الثانية لحل مسائل قانون النسب الثابتة
يمكن إيجـاد النسبة المئوية باسـتـخـدام الوزن الذرري للعنصر والوزن الجزيئي للمركب حسب القانون التالي:

مثال (1): احسب النسبة المئوية للعناصر المكونة للماء H2O الاوزان الذرية : ( O = 16 ، H = 1)
الحل:
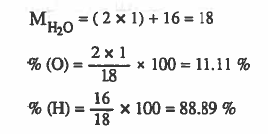
مثال (2): احسب النسبة المئوية العناصر في مركب كبريتات الصوديوم Na2SO4 ، علماً بأن الأوزان الذرية :
Na = 23 ، S = 32 ، O = 16
الحل: