الوزن الجزيئي ووزن الصيغة
الوزن الجزيئي Molecular weight
- تعريف الوزن الجزيئي: هو مجموع الأوزان الذرية للذرات المكونة للجزي . ويرمز له بالرمز Mw
- يستخدم الوزن الجزيئي للمركبات التي توجد على هيئة جزيئات في الطبيعة ، والتي تمثلها المركبات التساهمية ، مثل مركب سكر الجلوكوز C6H12O6.
وزن الصيغة Formula weight
- تعريف وزن الصيغة: هو مجموع الأوزان الذرية للذرات المكونة للصيغة . ويرمز له بالرمز Fw
- يستخدم وزن الصيغة للمركبات التي توجد على هيئة أيونات أو جزيئات في الطبيعة ، ومن الأمثلة على المركبات التي تـحـتـوي على أيونات : المركبات الأيونية مثل مركب ملح الطعام (كلوريد الصوديوم) NaCl .
مسائل محلولة
مثال (1): أوجد الوزن الجزيئي Mw للجزيئات التالية : H2O , Cl2 علماً بأن الأوزان الذرية: 1 = C1 = 35.5 , O = 16 , H
الحل:
الوزن الجزيئي لـ Cl2:
MwCl2 = 2 × 35.5 = 71 u
الوزن الجزيئي لـ H2O :
MH2O = (2 × 1) + 16 = 18 u
مثال (2): اوجد وزن الصبغة Fw لما يلي : Na2SO4 , NaCl علماً بأن الأوزان الذرية : 23 = O = 16 , Cl = 35.5 , S = 32, Na
الحل:
الوزن الصيغي لـ NaCl :
FwNaCl = 23 + 35.5 = 58.5 u
الوزن الصيغي لـ : Na2SO4
FwNa2SO4 = (2 × 23) + 32 + (4 × 16) = 142 u
ملاحظات هامة
- يستخدم الوزن الجزيئي بنفس اسـتـخـدام وزن الصيغة إلا أن وزن الصيغة يشمل الوزن الجزيئي .
- إلا أن الكثير من الكتب تستخدم مصطلح الوزن الجزيئي للمركبات الأيونية أو التساهمية وذلك للتسهيل فقط
- لذلك تجـاوز أسـوف نـتـفـق على كـتـابـة الـوزن الجـزيـئي ( M ) ليـشـمـل المـركـبـات الايونيـة والتساهمية .
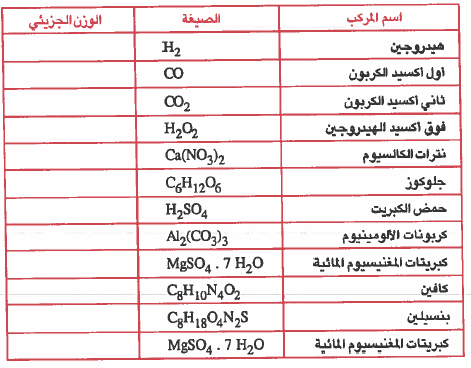
تمرين: إذا علمت أن الاوزان الذرية للعناصر التالية كما يلي : H = 1 , C = 12 , N = 14 , O = 16 , Mg = 24.3 , Al = 27, S = 32.1, Ca = 40.1 فأ كمل الفراغات في الجدول التالي :
( قم بحل هذا المثال واتركه لنا فى التعليق على الإجابة )
المصادر: كتاب تبسيط الكيمياء العامة - الجزء الأول - الطبعة الأولى 2005/2006 - إعداد الدكتور/ سعيد عبدالله بالبيد