المحصول النظري والمئوي Theoretical Yield and Percentage
تعريف المحصول النظري (المردود النظري)
هو كمية النواتج التي نحصل عليها على افتراض أن المواد المتفاعلة تتفاعل كلياً لتعطي هذا الناتج فقط .
تعريف النسبة المئوية للانتاج
هو مقياس لمدى كفائة التفاعل ويساوي:

مثال توضيحي:
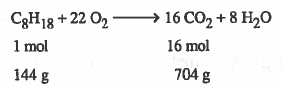
من المعادلة يتبين انه عند تفاعل 144g من الأوكـتـان (C8H18) كليـاً فإنه ينتج 704g مـن CO2 وهذا الناتج هو المفترض نظرياً ، ولكن الواقع قد يكون غير ذلك ، حيث يكون الناتج الحقيقي عن التفاعل أقل من الناتج النظري. ، وذلك يعود لأسباب منها :
لماذا يكون الناتج الحقيقي أقل من الناتج النظري؟
يكون الناتج الحقيقي عن التفاعل أقل من الناتج النظري. ، وذلك يعود لأسباب منها :
(1) عدم حدوث تفاعل كامل وعدم استرجاع مواد التفاعل المتبقية.
مثال : من المعلوم أن الهيدروكربونات عندما تحترق ينتج عن ذلك CO2 , H2O فقط ولكن عندما يكون الاحتراق غير كامل وذلك لنقص الأكسجين يظهر نواتج جانبية مثل أول أكسيد الكربون CO والكربون C وهذا يؤثر على الناتج.
(2) حدوث تفاعلات جانبية.
(3) أثناء عملية التنقية أو الفصل فى التجارب العملية يحدث فقد جزء من الناتج.
مسائل محلولة
مثال(1): في إحدى الـتـجـارب قام طالب بتـحـضير برومـو بنزن ( C8H8Br ) وذلك باستخدام 15.7g من البنزن C6H6 حسب التفاعل التالي:
C6H6 + Br2 → C6H5Br + HBr
(أ) احسب الحد الاقصى لما ينتج من C6H5Br (الناتج النظري) .
(ب) إذا كان الطالب قـد حصل على 7g من C6H5Br فـمـا النسبة المئوية للناتج الفعلي .
الأوزان الذرية : 80 = H =1 & C = 12 & Br
الحل :

مثال (2): إذا مزج 21g من غاز النيتروجين (N2) مع 6g مـن (H2) عـن درجـة C° 500 ونتج عن هذا التفاعل 8.8g من النشادر فـاحـسب النسبة المئوية للنشادر النائح (NH3) في هذا التفاعل :
N2 + 3 H2 → 2 NH3
الأوزان الذرية : 14 = H = 1 & N
الحل:
في البداية نوجـد النـاتج النظري للنشـائر ، ولا يتم ذلك إلا بمعرفة المادة المحددة للتفاعل (التي تتفاعل كليا) كما يلي:

المصادر: كتاب تبسيط الكيمياء العامة - الجزء الأول - الطبعة الأولى 2005/2006 - إعداد الدكتور/ سعيد عبدالله بالبيد