الأوزان المكافئة
- يمكن إيجاد العيارية بقسمة عدد الاوزان المكافئة على حجم المحلول باللتر.
ويمكن أن نوجد عدد الأوزان المكافئة بقسمة وزن المادة بالجرام على الوزن المكافيء.
ولكي نوجد الوزن المكافىء (EM) فإن ذلك يعتمد على نوع المادة كما يلي:
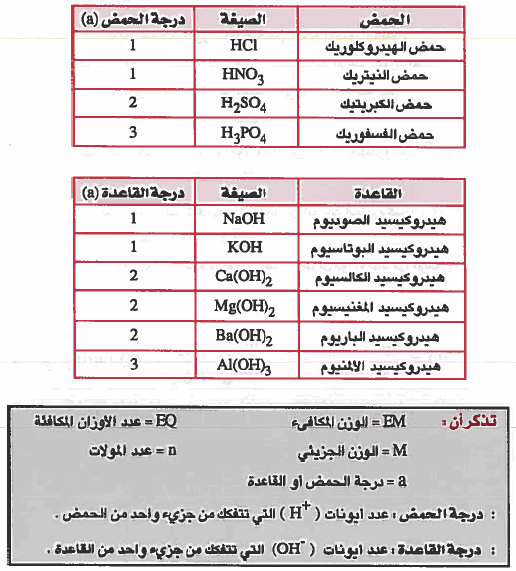
(أ) الوزن المكافيء للحمض (الكتلة المكافئة للحمض)
هو كمية الحمض التي تعطي عند تفككها مول واحد من أبونات الهيدروجين (+H) .
(ب) الوزن المكافيء للقاعدة (الكتلة المكافئة للقاعدة):
هو كمية القاعدة التي تعطي عند تفككها مول واحد من أيونات الهيدروكسيد (-OH)
(جـ) الوزن المكافيء للملح (الكتلة المكافئة للملح):
هو كمية الملح التي تفقد عند الأكسدة وتكتسب عند الاختزال مول واحد من الإلكترونات.
القوانين المستخدمة لحساب الأوزان المكافئة

مسائل محلولة على الأوزان المكافئة
سوف ناخذ الآن تطبيقات على الأوزان المكافئة ، وحتى لا يحدث لبس سوف نقسم التطبيقات إلى جزئين كما يلي:
أولاً/ تطبيقات على الأوزان المكافلة للأحماض والقواعد
مثال (1): احسب الوزن المكافيء للمواد التالية:
(1) HCl
(2) H2SO4
(3) NaOH
(4) Al(OH)3
علماً بأن الأوزان الذرية : 35.5 = H = 1 , O = 16 , Na = 23 , Al = 27 , S = 32 , C1
الحل :

مثال(2): أوجد عدد الأوزان المكافئة 1.26g HNO3
الحل:
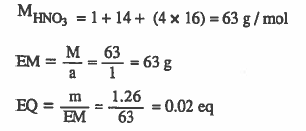
ملاحظات : eq = وحدة وزن مكافىء ، M = الوزن الجزيئي ويساوي عددياً وزن المول بوحدة g / mol
مثال (3): أوجد عدد الأوزان المكافئة 3mol H3PO4
الحل:
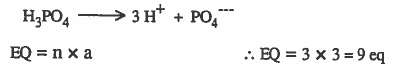
مثال (4): اوجد عدد مولات 2(2eq Ba(OH
الحل :
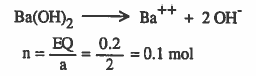
مثال (5): ما عدد جرامات 0.8eq H3PO4
الحل:

(۲) تطبيقات على الأوزان المكافئة للأملاح
أمثلة تبين كيفية إيجاد عدد الإلكترونات المؤكسلة أو المختزلة
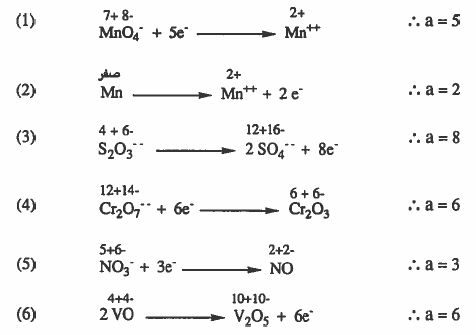
مثال (6): احسب الوزن المكافىء لكل مما يلي:
(۱) دیگرومات البوتاسيوم K2Cr2O7 عند اختزالها إلى +++Cr
(۲) برمنجنات البوتاسيوم KMnO4 عند اختزاله إلى MrO2 .
الأوزان الذرية : 55 = O = 16 , K = 39 , Cr = 52 , Mn
الحل:
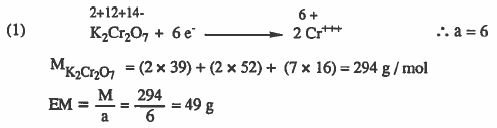
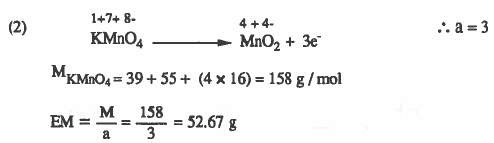
مثال(7): أجر التحويلات التالية :
(1) 5mol من KMnO4 إلى أوزان مكافئة. (ناتج التفاعل ++Mn)
(2) 3eq من Na2SO3 إلى مولات. (ناتج التفاعل Na2SO4)
(3) 20g من Fe2O3 إلى أوزان مكافئة. (ناتج التفاعل FeO)
الحل:
