نظرية القاعدة الثمانية The Octet Rule
- توصل العالم كوسل ولويس عام 1916م إلى نظرية القاعدة الثمانية أو ما تسمى بالنظرية الإلكترونية للتكافؤ (Electronic Theory of Valency) والتي تبين كيفية ترابط الذرات مع بعضها البعض في المركبات التساهمية.
نص نظرية القاعدة الثمانية
- جميع الذرات تميل إلى أن تصل إلى التركيب الثماني والمماثل لأقرب غاز خامل فيما عدا الهيدروجين والليثيوم والبريليوم التي تميل للوصول إلى تركيب ذرة الهيليوم (غاز نبيل) أي الكترونين في المجال الخارجي.
- الرابطة التـسـاهمـية تتكون نتيجة لمشاركة الذرتين المرتبطتين بزوج او أكـثـر من الإلكترونات بحيث يصبح التركيب الإلكتروني لمدار التكافؤ (المدار الأخير) لكل منهما يحتوي على ثمان إلكترونات.
- يمكن معرفة عدد الروابط التساهمية التي تكونها أي ذرة من خلال عند الإلكترونات التي تشارك بها الذرة للوصول إلى التركيب الثماني.
- وسوف نأخذ بعض الأمثلة على تكوين الرابطة التساهمية في ضوء القاعدة الثمانية
مثال (1) : كيفية تكون الرابطة (Cl-Cl) في جزيء الكلور Cl2
التركيب الإلكتروني لذرة الكلور:
17Cl: 1s2 2s2 2p6 3s2 3p5
تلاحظ أن المجال الخارجي لذرة الكلور يحتوي على سبع إلكترونات ، وبالتالي سوف تشارك كل ذرة بالكترون لتتكون رابطة واحدة ويصبح مجالها الأخير يحتوي على ثمان إلكترونات ، أي تصل إلى التركيب الثماني.
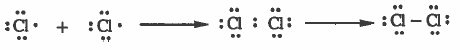
مثال (2): كيفية تكون الرابطة (H - H) في جزيء الهيدروجين H2
التركيب الإلكتروني لذرة الهيدروجين:
1H: 1s1
نلاحظ أن المجـال الخارجي لذرة الهيدروجين يـحـتـوي على إلكترون واحد ، وبالتالي سوف تشارك كل ذرة بإلكترون لتتكون رابطة واحدة ويصبح مجالها الأخير يحتوي على إلكترونان أي يشبه تركيب الغاز النبيل الهيليوم ( 2He ) وبذلك تصل الذرتان إلى حالة استقرار.
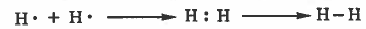
مثال (3) : كيفية تكون الرابطة (N - H) في جزيء NH3
التركيب الإلكتروني لذرة النيتروجين:
7N: 1s2 2s2 2p3
التركيب الإلكتروني لذرة الهيدروجين:
H1: 1s1
نلاحظ أن المجال الخارجي لذرة النيتروجين يحتوي على خمس إلكترونات ، وبالتالي سوف تشارك ذرة النيتروجين بثلاث إلكترونات أي تتكون ثلاث روابط ويصبح مـجـالـهـا الأخير يحتوي على ثمان إلكترونات ، أي تصل إلى التركيب الثماني>
أما بالنسبة للهيدروجين فيشارك بإلكترون ويصبح مجاله الأخير يحتوي على إلكترونين ، أي يصل إلى تركيب غاز الهليوم (He).
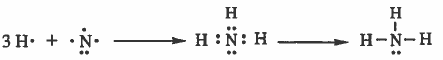
مثال (4): كيفية تكون الرابطة (O - H) في جزيء H2O
التركيب الإلكتروني لذرة الأكسجين:
7O: 1s2 2s2 2p4
التركيب الإلكتروني لذرة الهيدروجين:
H1: 1s1
نلاحظ أن المجـال الخارجي لذرة الأكسجين يـحـتـوي على سـتـة إلكترونات ، وبالتالي سوف تشارك ذرة الأكسجين بإلكترونين أي تتكون رابطتان ويصبح مـجـالها الأخير يحتوي على ثمان الكترونات ، أي تصل إلى التركيب الثماني.
أما بالنسبة للهيدروجين فيشارك بإلكترون ويصبح مجاله الأخير يحتوي على إلكترونين ، أي يصل إلى تركيب غاز الهليوم (He)
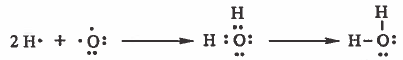
يتبين مما سبق (حسب القاعدة الثمانية) أن :
عدد الروابط في الذرة = عدد الإلكترونات التي تشارك بها الذرة