نظرية قاعدة الثمانيات
- تنص قاعدة الثمانيات على أن: جميع الذرات تميل إلى أن تصل إلى التركيب الثماني والمماثل لأقرب غاز خامل فيما عدا الهيدروجين والليثيوم والبريليوم التي تميل للوصول إلى تركيب ذرة الهيليوم (غاز نبيل) أي الكترونين في المجال الخارجي.
- يمكنك قراءة هذا الشرح المفصل عن: قاعدة الثمانيات
الحيود عن القاعدة الثمانية Violation of the octet rule
كما لاحظت أن لويس قام برسم الجزيئات على أساس أن الذرة في الجزيء يجب أن تحتوي في المجال الخارجي على ثمـان إلكترونات . ولكن هذه القاعدة لم تنطبق على كل الجزيئات ، ويمكن توضيح ذلك من خلال الأمثلة التالية:
أمثلة على بعض الجزيئات التي لا تنطبق عليها القاعدة الثمانية
مثال (1): جزيء كلوريد البريليوم BeCl2
التركيب الإلكتروني لذرة البريليوم:
4Be : 1s2 2S2
نلاحظ أن المجال الخارجي لذرة البريليوم تحتوي على إلكترونين ، وبالتالي سوف تشارك ذرة البريليـوم بإلكترونين ويصبـح مـجـالـهـا الأخير يحتوي على أربع إلكترونات، وهذا يخالف القاعدة الثمانية.
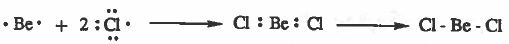
مثال (2): جزيء خامس كلوريد الفسفور PCl5
التركيب الإلكتروني لذرة الفسفور:
15P : 1s2 2s2 2p6 3s2 3p3
نلاحظ أن المجال الخارجي لذرة الفسفور يحتوي على خمس إلكترونات ، وعن
دما تشارك ذرة الفسفور بخمس إلكترونات ويصبح مـجـالـهـا الأخـيـر يـحـتـوي على عشر إلكترونات، وهذا يخالف القاعدة الثمانية.

مثال (3): جزيء سادس كلوريد الكبريت SCl6
التركيب الإلكتروني لذرة الكبريت:
16S : 1s2 2s2 2p6 3s2 3p4
نلاحظ ان المجال الخارجي لذرة الكبريت يحتوي على ستة إلكترونات، وعندما تشارك ذرة الكبريت بست إلكترونات ويصبح مجالها الأخير يحتوى على إثنى عشر إلكترون، وهذا يخالف القاعدة الثمانية.

أشكال الحيود على القاعدة الثمانية
هناك صور مختلفة للجزيئات التي لا تنطبق عليها القاعدة الثمانية وهي:
(1) جزيئات يحتوي المدار الخارجي للذرة المركزية على أكثر من ثمان إلكترونات مثل: خامس كلوريد الفسفور (PCl5) ، سادس فلوريد الكبريت (SF6)

(2) جزيئات يحتوي المدار الخارجي للذرة المركزية على أقل من ثمان إلكترونات مثل كلوريد البريليوم (BeCl2).
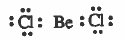
(3) جزيئات يحتوي المدار الخارجي للذرة المركزية على إلكترون منفرد:
مثل: جزيء أكسيد النيتروجين ( NO):
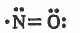
وجزيء ثاني أكسيد النيتروجين (NO2):
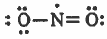
عيوب نظرية القاعدة الثمانية
(1) لم تستطع أن تفسر الترابط في بعض الجزيئات مثل: BeCl2 , PCl5 , SCl6
(2) لم تستطع أن تفسر الزوايا بين الروابط والشكل الفراغي للجزيء.
(3) ذكرت النظرية أن الغازات الخاملة لا تتفاعل ، لأن مجالها الخارجي ممتلىء بالإلكترونات.
وقد ثبت أن هذه الغازات يمكن أن تتفاعل وتكون مركبات ثابتة .
أسئلة هامة عن قاعدة الثمانيات
سؤال (1): لماذا لا يتجاوز عدد إلكترونات عناصر الدورة الثانية عن ثمانية إلكترونات ابداً في مجالها الأخير (مجال التكافؤ) ، بينما عناصر الدورة الثالثة يمكن أن يتجاوز المجال الأخير لها ثمانية إلكترونات .
الحل:
- عناصر الدورة الثانية لا يمكن أن تتجاوز القاعدة الثمانية وذلك لأن سعة المستوى الرئيسي الثاني (8 إلكترونات) فقط.
(2s2 2p6)
- أما عناصر الدورة الثالثة وما بعدها فمجالها الأخير (غلاف التكافؤ) يمكن أن يستوعب أكثر من ثمان إلكترونات بسبب وجود المستوى الفرعي الفارغ 3d
(3s2 3p6 3d10)
- ولذلك فإن بعض عناصر الدورة الثالثة يمكن أن تتجاوز القاعدة الثمانية مثل الفسفور في مركب PCl5 ، والكبريت في مركب SCl6
سؤال (2): أي المركبات لا يتبع قاعدة الثمانيات:
BCl3 , NO2 , IF7 , SO2 , SF4 , OF2 , CIF3
ملاحظة: للحل هذا السؤال يتم اولاً رسم تركيب لويس ، ثم ننظر للذرة المركزية فإذا كان عدد الإلكترونات حول الذرة المركزية أكثر أو أقل من ثمانية ، فإن المركب لا يتبع القاعدة الثمانية.
الحل: BCl3 , NO2 , IF7 , SF4 , ClF3