نظريات تفسير تكون الروابط التساهمية
لجا العلماء إلى ميكانيكا الكم لتفسير كيفية تكون الرابطة التساهمية فظهر نتيجة لذلك نظریات توضح وتفسر كيفية تكون الرابطة التساهمية بين الذرات ومن أشهر هذه النظريات :
(1) نظرية رابطة التكافؤ (VBT) .
(2) نظرية المدارات الجزيلية (MO) .
تعريف نظرية رابطة التكافؤ (VBT) Valence Bond Theory
الرابطة التساهمية هي رابطة ناتجة عن تداخل مدار ذري لأحد الذرات به إلكترون منفرد مع مدار ذري لذرة أخرى به إلكترون منفرد.
كيفية تكون الرابطة التساهمية حسب نظرية رابطة التكافؤ (VBT)
يمكن توضيح كيفية تكون الرابطة التساهمية حسب الخطوات الآتية:
(1) تتقارب الذرتان من بعضهما
(2) تقدم كل ذرة مداراً ذرياً نصف ممتلىء أي يحتوي على إلكترون منفرد .
(3) عندما تتقارب الذرتان من بعضهما يحدث تداخل Overlap بين المدارين .
(4) نتيجة لهذا التداخل تتكون منطقة مشتركة في الفراغ الكائن بين نواتي الذرتين.
(5) يحتل الزوج الإلكتروني منطقة التداخل أي أن الكثافة الإلكترونية تتركز بين نواتي الذرتين وهذان الإلكترونان يدوران حول نفسهما في اتجاهين متعاكسين. وهذا الزوج الإلكتروني ينتمي إلى كلا الذرتين .
(6) نتيجة لوجود كثافة إلكترونية بين نواتي الذرتين ، فإن نواتي الذرتين الموجبتين تنجذبان نحو الكثافة الإلكترونية السالبة إلى أقصى حد ممكن ، وبذلك تتقارب الذرتان من بعضهما ، وبذلك تتكون الرابطة التساهمية .
(7) تزداد قوة الرابطة التساهمية بازدياد التداخل بين المدارات الذرية .
سؤال هام: لماذا تلجأ المدارات في الذرات لعملية التداخل .
جـواب: وذلك لأن قـوى الـتـجـاذب بين الذرتين أكـبـر مـن قـوى الـتـنـافـر الناتجة عن تنافر إلكترون - إلكترون وكذلك بروتون - بروتون . أي أن الطاقة الكامنة للنظام بعد التداخل اقل منها قبل التداخل .
- فكرة تداخل المدارات الذرية لتكوين الروابط الـتـسـاهـمـيـة سهلت علينا فهم طريقة تكوين هذه الروابط في العديد من الجزيئات او الأيونات.
أنواع التداخلات بين المدارات
- التداخلات بين المدارات تنقسم إلى نوعين:
(1) تداخل رأسي وينتج عنه رابطة من نوع سيجما (σ - Bond)
(2) تداخل جانبي وينتج عنه رابطة من نوع باي (π - Bond)
الرابطة سيجما (σ - Bond)
- تعريف الرابطة سيجما (σ - Bond) هي رابطة ناتجة عن تداخل الأفلاك بالرأس وتـتـوزع الكثافة الإلكترونية بشكل متماثل على طول المحور الواصل بين نواتي الذرتين.
- وإليك أمثلة على تداخلات بين المدارات الذرية لتكوين روابط من نوع سيجما (σ)
(1) التداخل بين مدار (s) ومدار (s) : تداخل رأسي وينتج عن ذلك رابطة من نوع (σ):
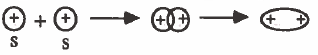
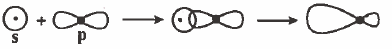
(2) التداخل بين مدار (s) ومدار (p) : تداخل راسي وينتج عن ذلك رابطة من نوع (σ):
(3) التداخل بين مدارات (p) الأفقية: تداخل رأسي وينتج عن ذلك رابطة من نوع (σ):
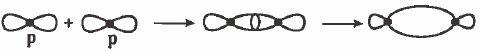
نلاحظ أن مدارات (S) غير متجهة لأن مدار (ٍS) كروي وبذلك يمكن أن يتداخل مع المدارات الأخرى من أي اتجاه.
الرابطة باي (π - Bond)
- تعريف الرابطة باي (π - Bond) : رابطة ناتجة عن تداخل الأفلاك بشكل جـانبي وتتوزع الكثافة الإلكترونية في منطقتين على جانبي المحور الواصل بين نواتي الذرتين.
- مثال: التداخل بين مدارات (p) المتوازية: تداخل جانبي من نوع (π ) .
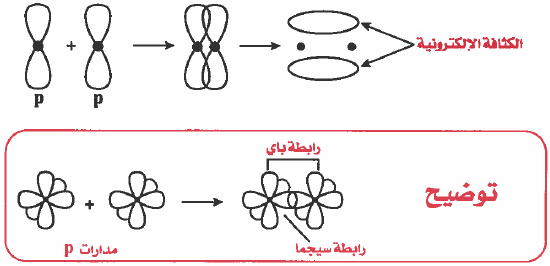
ملاحظة: الرابطة سيجما أقوى من الرابطة باي (علل) وذلك لأنه في الرابطة سيجما الكثافة | الإلكترونية تتوزع بشكل متماثل على طول المحور الواصل بين نواتي الذرتين . بينما في الرابطة باي فإن الكثافة الإلكترونية تكون أعلى وأسفل الخط الوهمي الواصل بين نواتي الذرتين.
