كيفية تكون الرابطة التساهمية حسب نظرية رابطة التكافؤ (VBT)
يمكن توضيح كيفية تكون الرابطة التساهمية حسب الخطوات الآتية:
(1) تتقارب الذرتان من بعضهما
(2) تقدم كل ذرة مداراً ذرياً نصف ممتليء أي يحتوي على إلكترون منفرد.
(3) عندما تتقارب الذرتان من بعضهما يحدث تداخل Overlap بين المدارين.
(4) نتيجة لهذا التداخل تتكون منطقة مشتركة في الفراغ الكائن بين نواتي الذرتين.
(5) يحتل الزوج الإلكتروني منطقة التداخل أي أن الكثافة الإلكترونية تتركز بين نواتي الذرتين وهذان الإلكترونان يدوران حول نفسهما في اتجاهين متعاكسين. وهذا الزوج الإلكتروني ينتمي إلى كلا الذرتين.
(6) نتيجة لوجود كثافة إلكترونية بين نواتي الذرتين ، فإن نواتي الذرتين الموجبتين تنجذبان نحو الكثافة الإلكترونية السالبة إلى أقصى حد ممكن ، وبذلك تتقارب الذرتان من بعضهما ، وبذلك تتكون الرابطة التساهمية.
(7) تزداد قوة الرابطة التساهمية بازدياد التداخل بين المدارات الذرية .
كيفية تكون الرابطة التساهمية من نوع (σ) في جزيء الهيدروجين H2 حسب نظرية رابطة التكافؤ (VBT)
- التركيب الإلكتروني لذرة الهيدروجين:
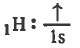
- نلاحظ أن كل ذرة هيدروجين تحتوي على مدار ذري ( 1s ) يحتوي على إلكترون منفرد ( نصف ممتلئ).
- يحدث تداخل بين المدارين الذريين بحيث يتواجد الزوج الإلكتروني في منطقة التداخل ، وينتج عن هذا التداخل تكون الرابطة التساهمية ، وهذه الرابطة تسمى سيجما (σ) .
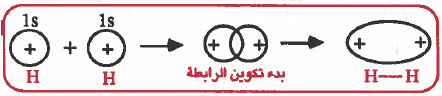
ملاحظة: جزيئات الهيدروجين أكثر ثباتاً من ذرات الهيدروجين المفردة (علل) وذلك لأن الزوج الإلكتروني الرابط بين ذرتي الهيدروجين مـجـذوباً من نواتي الترتين في آن واحد بعكس الذرة المفردة والتي يكون إلكترونها مجذوباً من نواة واحدة فقط.
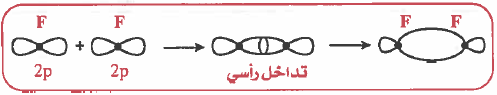
(2) كيفية تكون الرابطة التساهمية من نوع (σ) في جزيء الفلور F2 حسب نظرية رابطة التكافؤ (VBT)
- التركيب الإلكتروني لذرة الفلور:
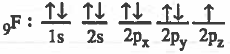
- نلاحظ ان كل ذرة الفلور تحتوي على مدار ذري (2p2) يحتوي على إلكترون منفرد يحدث تداخل بين المدارين الذريين ( 2Pz ) بحيث يتواجد الزوج الإلكتروني في منطقة التداخل.
- وينتج عن هذا التداخل تكون الرابطة التساهمية وهذه الرابطة تسمى سيجما ( σ)