الذوبان The Solubility
- الذوبان : هو توزيع دقائق ( جزيئات أو ايونات أو ذرات ) مذاب بين جزيئات منيب
- تعتمد عملية الذوبان على عامل رئيسي وهو قوى التجاذب بين الجزيئات . وهذه القوى التي تربط وحدات المذاب مع وحدات المذيب أنواع وهي كما يلي:
قوی فاندرفالس Vander Waals Forces
وهما نوعان:
(أ) قوى لندن London Forcec
- هذه القوى تنشاً بين الجزيئات غير القطبية (عـزمـهـا القطبي يساوي صفر) مثل البنزين C6H6 ، رابع كلوريد الكربون CCl4 ، الهيدروكربونات كالإيثلين مثلاً CH4 وغيره ويزداد تأثير هذه القوى كلما اقتربت الجزيئات من بعضها.
- وهذه القوى هي عبارة عن تجاذب بين إلكترونات ذرات جزيء ونوى ذرات جزيء آخر.
- وكلما زاد حجم الجزيء (الوزن الجزيئي) تزداد هذه القوى مقداراً.
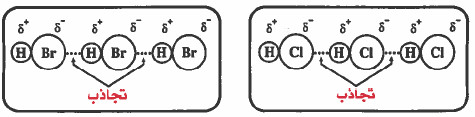
(ب) قوى ثنائي القطب - ثنائي قطب Dipole - Dipole Attractive Forces
- هذه القوى تنشأ بين الجزيئات القطبية مثل كلوريد الهيدروجين HCl ، بروميد الهيدروجين HBr ، كلوريد اليـود ICl ، كلوروفورم CH3Cl ، ثنائي كلورو مـیثان CH3Cl.
- وتزداد مقدار القوى بازدياد قطبية الجزيئات ، فمثلاً التجاذب بين جزيئات كلوريد الهيدروجين HCl أقوى من التجاذب بين جزيئات بروميد الهيدروجين HBr وذلك لأن قطبية HCl أعلى من قطبية HBr.
الرابطة الهيدروجينية Hydrogen Bond
وهذه الرابطة لا تختلف عن القوى ثنائية القطب إلا أنها تمتاز بكون ذرة الهيدروجين طرفاً في الرابطة.
- وإليك أمثلة على الروابط الهيدروجينية:
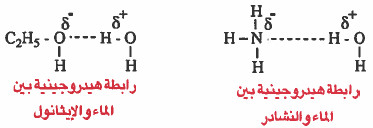
- وتـعـتـمـد قـوة الرابطة الهيدروجينية على قطبـيـة الجـزيئات. فالروابط الهيدروجينية بين جزيئات الماء أقوى منها بين جزيئات النشادر . وذلك لان السالبية الكهربية للأكسجين الموجود في الماء أعلى من السالبـيـة الكـهـربيـة للنيتروجين الموجود في النشادر.
المثل يذيب المثل Like Dissolve Like
- ونقصد بذلك مـثـلاً المواد القطبية أو الأيونية تنوب في المذيبات القطبية، فمثلاً كلوريد الصوديوم أو الإيثانول يذوبان في الماء.
- والمواد غـيـر القـطـبـيـة كـالهيدروكربونات (تتكون من كربون وهيدروجين فقط) تذوب في المذيبات غير القطبية كالبنزين C6H6 ورابع كلوريد الكربون CCl4 . فعند إضافة البنزين أو رابع كلوريد الكربون إلى الماء لا تمتزج ، بل تتكون طبقتين من السائل.
المحاليل الجزيئية Molecular Solutions
- مما سبق يمكن أن نتوصل إلى أنه عند تشابه القوى بين الجزيئات فإنها تنوب في بعضها البعض ، فمثلاً : - رابع كلوريد الكربون يذوب في البنزين وذلك لأن القوى في كليـهـمـا من نوع فاندفالس . وبذلك فإنها يرتبطان مع بعضهما بقوى فائرفالس.
- الإيثانول (قطبي) ينوب في الماء (قطبي) وذلك لانهـمـا يرتبطان مع بـعـضـهـمـا بروابط هيدروجينية ، وهي نفس القوى التي توجد بين جزيئات الماء أو بين جزيئات الإيثانول.
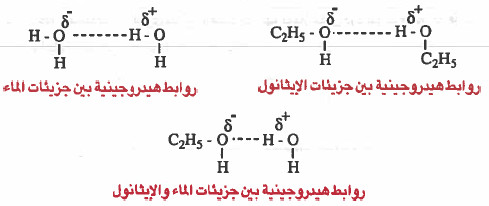
- رابع كلوريد الكربون (غـيـر قطبي) لا يذوب في الماء (قطبي) وذلك لأن الروابط الهيدروجينية التي بين جزيئات الماء أقوى من روابط فـاندـرفـالس التي بين جزيئات رابع كلوريد الكربون ، ولذلك تطرد جزيئات الماء جـزيلات رابع كلوريد الكربون لتتشكل طبـقـتين منفصلتين.
المحاليل الأيونية Ionic Solutions
- المركبات الأيونية هي التي تحتوي على أيونات موجبة ( كاتيونات Cations ) وعلى أيونات سالبة ( أنيونات Anions ) . مثل كلوريد الصوديوم "NaCl .
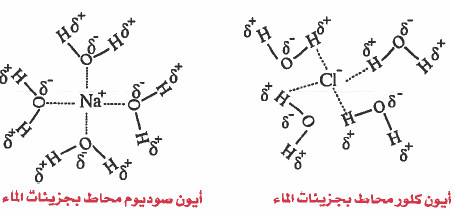
كيفية ذوبان كلوريد الصوديوم في الماء
عندما نضع كـمـيـة مـن ملـح الـطـعـام NaCl في الماء فإنه يتفكك إلى أيونات مـوجـبـة +Na وأيونات سالبة -Cl ، حيث يحدث تجاذب كهربي بين أيونات الصوديوم الموجبة وأكسجين الماء الذي يحمل شحنة جزئية سالبة . كذلك يحدث تجاذب كهربي بين ايونات الكلور السالبة وهيدروجين الماء الذي يحمل شحنة جزئية موجبة .
- والذي يحدث هو أن جزيئات الماء تحيط بأيونات الصوديوم وأيونات الكلور كل على حدة ، وتتغلب قوى التجاذب الجديدة على الرابطة الأيونية ، وبالتالي تنفصل الايونات عن بعضها لتصبح حرة الحركة داخل الماء (ايونات مميهة).
سؤال: هل يذوب اليود (I2) في رابع كلوريد الكربون (CCl4) ؟ ولماذا ؟
الحل : اليـود (غير قطبي) ينوب في رابع كلوريد الكربون (غير قطبي) ، وذلك لأن القوى التي توجد بين جزيئات I2 (قوی فاندرفالس) تشبه القوى التي توجد بين جزيئات CCl4