ذائبية غاز في سائل Solutions of Gases in Lquids
- تذوب الغازات في السوائل ولهذه العملية أهمية كبيرة ، فلولا أن الأكسجين ينوب في ماء البحر لماتت الأحياء البحرية.
تعريف ذائبية الغاز في السائل
هو حجم الغاز بوحدة (cm3) الكافي لاشباع (cm3) من السائل عند الظروف العيارية.
تعریف معامل الامتصاص
هو حجم الغاز الذي يذوب في حـجـم معين من السائل عند الظروف العيارية ( ضغط جـوي واحد ودرجة صفر درجة مئوية).
العوامل المؤثرة على ذائبية الغازات في السوائل
(1) طبيعة (نوعية) المذاب والمذيب
(2) ضغط الغاز فوق السائل .
(3) درجة الحرارة .
(4) وجود مواد ذائبة في السائل
وسوف نشرح هذه العوامل بالتفصيل كما يلي .
أولاً/ أثر طبيعة المذاب والمذيب
أقسام الغازات من حيث درجة ذوبانها في الماء
(۱) غازات شـحـيـحـة الذوبان
تمتاز هذه الغازات بأنها لا تتفاعل كيميائياً مع الماء مثل النيتروجين في الماء ، الهيدروجين في الماء ، الأكسجين في الماء.
(۲) غازات سهلة الذوبان في الماء
تمتاز هذه المواد بأنها تتفاعل مع الماء (لا تشكل محاليل حقيقية) ، مثل غاز كلوريد الهيدروجين ، غاز ثاني أكسيد الكبريت.
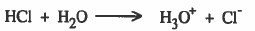
قاعدة هامة: المواد القطبية تذوب في المذيبات القطبية . والمواد غير القطبية تذوب في المذيبات غير القطبية.
ومن القاعدة السابقة نأخذ الأمثلة التالية :
(1) الغازات القطبية كغاز كلوريد الهيدروجين HCl ، غاز كبريتيد الهيدروجين H2S ثاني أكسيد الكبريت SO2 ، تذوب في الماء القطبي.
ملاحظة: غاز النشادر يذوب في الماء السائل وذلك لوجود روابط هيدروجينية بينهما .
(2) غاز النشادر NH3 لا ينوب في البنزين C6H6 لأن النشادر قطبي ، والبنزين غير قطبي.
(3) غـاز كلوريد الهيدروجين HCl بشكل عـام لا يذوب في البنزين C6H6 او رابع كلوريد الكربون CCl4 لان كلوريد الهيدروجين قطبي ، والبنزين ورابع كلوريد الكربون كلاهما غير قطبي.
(4) غاز اليود (12) ينوب في البنزين C6H6 ، لأن اليود غير قطبي ، والبنزين أو رابع كلوريد الكربون CCl4 كلاهما غير قطبي.
(5) ذائبـيـة غـاز الهيدروجين H2 والنيتروجين N2 والأكسجين O2 قليلة في الماء لأن هذه الغازات غير قطبية والماء قطبي.
(6) ذائبية غاز النشادر ، غاز كبريتيد الهيدروجين H2S ثاني أكسيد الكبريت SO2 في الماء أعلى منها في الكحول الإيثيلي وذلك لأن قطبية الماء أعلى من قطبية الكحول الإيثيلي.
ثانياً/ أثر الضغط على ذائبية الغازات في السوائل
- عند ثبوت درجة الحرارة تزداد ذوبانية الغازات في السوائل بزيادة ضغط الغاز فوق سطح السائل.
- بمعنى أنه كلما زاد تركيز جزيئات الغاز فوق السائل يزداد ذوبان جزيئات الغاز فيه.
- وقد توصل هنري إلى علاقة بين ضغط الغاز وذائبيته.
قانون هنري
- تعريف قانون هنري: " كـمـيـة الغاز المذابة في كتلة معينة من السائل المذيب عند درجة حرارة معينة تتناسب طردياً مع الضغط الجزئي للغاز فوق السائل".
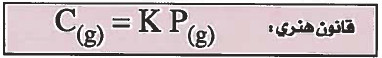
(g)C = تركيز الغاز (كمية الغاز) .
K = ثابت قانون هنري ، ويعتمد على طبيعة الغاز والسائل .
P(g) = الضغط الجزئي للغاز .
ملاحظات على قانون هنري
(1) يستفاد من القانون السابق في حساب كمية الغاز المذابة في مذيب ما.
(2) لا تنطبق العلاقة السابقة على الغازات التي تتفاعل مع المحلول.
(3) لا تنطبق العلاقة السابقة على الغازات شديدة الذوبان في السائل المذيب ، وكذلك التي لها خواص التفكك إلى أيونات أو التي لها خواص تجمعية.
(4) ينطبق القانون عندما تكون درجة الحرارة مرتفعة والضغط منخفضاً.
- لا يمكن تطبيق قانون هنري على ذائبية غاز كلوريد الهيدروجين في الماء وذلك لأن كلوريد الهيدروجين شديد الذوبان في الماء ، وكذلك لأنه يتفكك في الماءإلى أيونات
- يزداد ذوبان الغازات في السوائل بازدياد الضغط . يمكن تفسير ذلك باستخدام مبدأ لوشاتيليه:
(aq) محلول ↔ (g) مذاب + (l) مذیب
فعند زيادة الضغط فإن الجهة اليسرى تتأثر بالضغط بشكل أكبر ، أي ان كمية الغاز سوف تقل (تذوب) لتكوين زيادة من المحلول.
(5) حتى يمكن تطبيق القانون السابق يجب أن يكون النظام مغلق ، لأن النظام سوف يصل إلى حالة اتزان بين الضغط الجزئي فوق المحلول وكمية الغاز المذابة. وكما هو معلوم ان من خواص الاتزان استمرار الاتزان الديناميكي (النشط) بحيث أن كمية الغاز التي تفـقـد من المحـلـول يـقـابـلـهـا كـمـيـة مـسـاويـة تـدخل من الـغـاز إلى المحلول . وهذه الحالة تستمر طوال الزمن مادام النظام في حالة اتزان وعند ثبوت درجة الحرارة .
(6) بالنسبة لخليط من الغازات فإن كل غاز في الخليط يذوب كما لوكان بمفرده.
(7) كـمـيـة الـغـاز المذابة تـعـتـمـد على الضغط الجـزئـي للـغـاز فـوق المحلول وليس على ضغوط الغازات الأخرى إن وجدت.
(8) إذا كان لدينا غاز واحد في ظروف مختلفة وعند درجة حرارة ثابتة:
فإنه للغاز الأول : C1 = K P1
فإنه للغاز الثاني :C2 = K P2
وبقسمة معادلة الغاز الثاني على معادلة الغاز الأول ينتج القانون التالي:
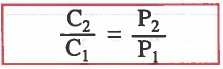
C1 = تركيز الغاز في الحالة الأولى
C2 = تركيز الغاز الثاني في الحالة الثانية
P1 = الضغط الجزئي للغاز في الحالة الأولى
P2 = الضغط الجزئي للغاز في الحالة الثانية