محاليل لا مثالية Non-ideal Solutions
تنحرف بعض المحاليل عن قانون راؤول، ويحدث ذلك عندمـا تخـتـلـف قـوى الـتـجـاذب بين المذاب والمذيب عن قوى التجاذب بين جزيئات المذيب النقي وكذلك بين جزيئات المذاب النقي وتسمى هذه المحاليل في هذه الحالة بالمحاليل اللامثالية.
تنقسم المحاليل اللامثالية إلى:
(۱) محاليل ذات حيود سالب عن قانون راؤول.
(۲) محاليل ذات حيود موجب عن قانون راؤول.
الانحراف السالب Negative Deviation
- هذا النوع من المحاليل أطلق علـيـه (ذو حـيـود أو انـحـراف سـالب) لأن الضـغـط البـخـاري للمحلول فيه أقل مما هو في المحلول المثالي.
- تمتاز المحاليل ذات الحيود السلبي بما يلي:
(1) قوى التجاذب بين جزيئات المحلول أقوى منها في السوائل النقية.
فمثلاً إذا مزج السائل A مع السائل B فإنه ينتج محلول AB فإن: قوى التجاذب الناتجة بين (A - B) أقوى من قوى التجاذب الأصلية بين جزيئات (A -A) وكذلك بين (B - B) .
A-A , B-B < A-B
ونتيجة لذلك فإن:
(أ) الـحـجـم الناتج بعـد المزج Vt أقل من مـجـمـوع حـجـم المذاب السائل VA وحجم المذيب السائل VB
Vt < VA + VB
(ب) ميل الجزيئات للهروب (للـتـبـخـر) من المحلول أقل من ميل الجزيئات للهروب في حـالـتـهـا السائلة النقية.
(جـ) الضغوط الجزيئية للمذاب والمذيب في المحلول وكذلك الضغط البخاري الكلي للمحلول أقل من الضغوط البخارية التي نحصل عليها من قانون راؤول.
(2) يصاحب هذا النوع من المحاليل ارتفاع في درجـة الحـرارة وهذا يعني ان عـمـليـة المزج طاردة للحرارة ( - = ΔH)
(3) نتيجة لانخفاض الضغط البخاري، فإن هذه المحاليل يصاحبها ارتفاع في درجة الغليان.
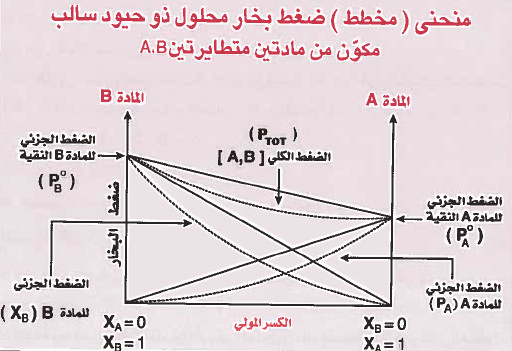
أمثلة على محاليل لا مثالية ذات حيود سالب:
(۱) حمض الكبريت وماء
(۲) حمض النيتروجين وماء
(۳) الأسيتون والكلوروفورم
ملاحظات هامة:
عند مزج الماء مع حمض الكبريت فإن حجم المحلول سوف يكون اقل من مـجـمـوع حجمي الماء وحمض الكبريت كل على حدة:
وذلك لأن قوى التجاذب بين الماء وحمض الكبريت أكبر من قوى التجاذب بين جزيئات حمض الكبريت وكذلك أقوى من قوى التجاذب بين جزيئات الماء ولهذا تتجاذب جزيئات الماء وجزيئات حمض الكبريت مما يؤدي إلى نقص الحجم.
الانحراف الموجب Positive Deviation
- هذا النوع من المحاليل أطلق علـيـه (ذو حـيـود او انـحـراف مـوجـب) لأن الضـغـط البـخـاري للمحلول فيه أكبر مما هو في المحلول المثالي.
- تمتاز المحاليل ذات الحيود الموجب بما يلي:
(1) قوى التجاذب بين جزيئات المحلول أضعف منها في السوائل النقية.
فمثلاً إذا مزج السائل A مع السائل B فإنه ينتج محلول AB فإن: قوى التجاذب الناتجة بين (A - B) اقل مـن قـوى الـتـجـاذب الأصلية بين جزيئـات (A - A) وكذلك بين (B - B) .
B-B > A-B , A-A
ونتيجة لذلك فإن:
(أ) الحجم الناتج بعد المزج VTOTAL أكبر من مـجـمـوع حـجـم المذاب السائل VA وحجم المنيب السائل VB
Vt > VA + VB
(ب) ميل الجزيئات للهروب (للتبخر من المحلول أكبر من ميل الجزيئات للهروب في حالتها السائلة النقية
(جـ) الضغوط الجزيئية للمذاب والمذيب في المحلول وكذلك الضغط البخـاري أعلى من الضغوط البخارية التي نحصل عليها من قانون راؤول.
(2) يصاحب هذا النوع من المحاليل انخفاض في درجة الحرارة وهذا يعني ان عملية المزج ماص للحرارة ( + = (ΔH.
(3) الضغط البخاري لكل سائل بعد المزج لا يخضع لقانون راؤول.
(4) نتيجة لارتفاع الضغط البخاري، فإن هذه المحاليل يصاحبها انخفاض في درجة الغليان.
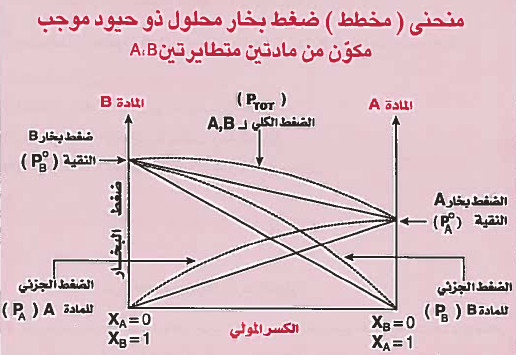
أمثلة على محاليل لا مثالية ذات حيود موجب:
(1) إيثانول وماء
(2) بريدين وماء
(3) إيثانول وهبتان
(4) ميثانول ورابع كلوريد الكربون
ملاحظات هامة:
عند مزج الماء مع الإيثانول فإن حجم المحلول سوف يكون أكـبـر مـن مـجـمـوع حجمي الماء والإيثانول كل على حدة؟
وذلك لأن قوى التجاذب بين الماء الإيثانول (في المحلول) أضعف من قوى التجاذب بين جزيئات الإيثانول، وكذلك أضعف من قوى التجاذب بين جزيئات الماء. ونتيجة لهذا النقص في التجاذب سوف تتباعد الجزيئات مما يؤدي إلى زيادة في الحجم.