القوانين المستخدمة لحساب الضغط الاسموزي (π)
- لمزيد من الشرح عن الضغط الأسموزي أقرا هذا الموضوع: شرح الضغط الأسموزي Osmotic Pressure بالتفصيل
- وقد وجد عملياً أن الضغط الاسموزي (π) يتناسب طردياً مع التركيز (C) ويتناسب طرديا مع درجة الحرارة المطلقة (Τ)
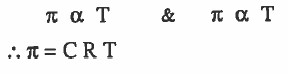
- بالنسبة للمحاليل المخففة يمكن إيجاد الضغط الاسموزي باستخدام مـعـادلـة فانت هوف للمحاليل المخففة.
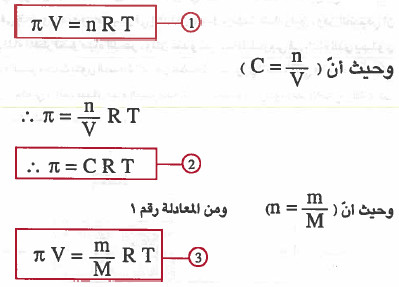
حيث أن:
π = الضغط الاسموزي بوحدة atm
V = حجم المحلول باللتر
R = ثابت الغازات (0.0821)
n = عدد المولات المذاب
m = الوزن بالجرام للمذاب
T = درجة الحرارة المطلقة (كالفن)
C = التركيز بالمولارية
M = الوزن الجزيئي للمذاب ( الكتلة المولية للمذاب )
مسائلة محلولة على الضغط الأسموزي
مثال (1): احسب الضغط الأسموزي π لمحلول 0.155M من الجلوكوز عند درجة °25C
الحل:
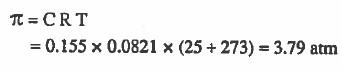
مـثال (2): احسب الضغط الاسـمـوزي لمحلول يـحـتـوي على 3g من الجلوكوز C6H12O6 في 250mL من المحلول عند °25C.
الحل:
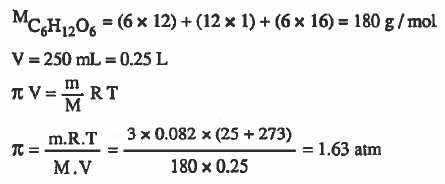
مـثال (3): إذا أدت إذابة 0.02g من بروتين في 1.5ml من الماء إلى الحصـول على محلول ضغطه الاسـمـوزي عند (293K) يساوي 9.7torr فـاحـسب الوزن الـجـزيـئي للبروتين.
الحل:
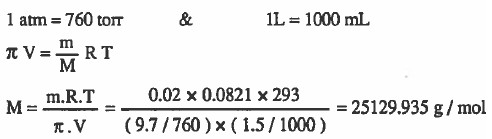
مـثال (4): احسب الوزن الجزيئي لمذاب مـا إذا كان الضغط الأسـمـوزي لمحلول يحتوي على 10g منه في اللتر يساوي 10torr عند 300K.
الحل:
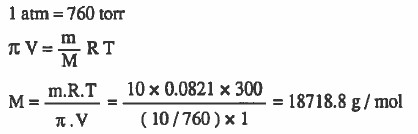
مـثال (5): احسب الوزن الجزيئي لنترات السليلوز المذابة في 790g من الأسيتون ليصبح حجم المحلول لتر واحد وضغطه الاسموزي 5-10 × 6.05 عند 293K علماً بأن وزن نترات السليلوز 1.16g ثم احسب الارتفاع في درجة الغليان إذا علمت أن ثابت الارتفاع في درجة الغليان ( Kb = 1.71 °C m-1 )
الحل:
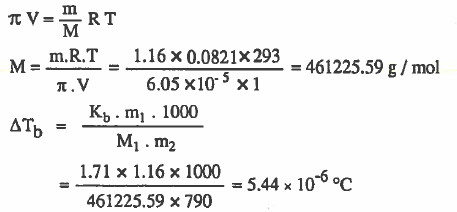
مثال (6): أذا كانت درجة تجمد محلول اليوريا فى الماء هي °0.52C - وإذا كان ثابت الانخفاض المولالي في درجة تجمد الماء Kf = 1.86 °C / molal فأحسب الضغط الأاسموزي على فرض أن التركيز بالمولالية يساوي التركيز بالمولارية عند °15C
الحل:

مـثال (7): عند 25C° احسب الضغط الاسموزي لمحلول مكون من 17g من مادة لا إلكتروليتية في 250ml من الماء فإذا كانت درجة تجمد المحلول °0.748C - علماً بأن Kf = 1.86 °C / molal افرض ان المولارية تساوي المولالية.
الحل:

مـثال (8): مادة صلبة أذيبت في 100g من الماء فاحسب درجة التجمد للمحلول إذا كان حجم المحلول 103mL علما بأن الضغط الاسموزي atm 0.25 عند °27C وأن ثابت الانخفاض في درجة التجمد Kf = 1.86 °C / m )
الحل:
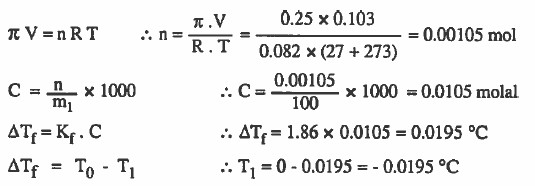
مثال (9): احسب الضغط الاسموزي لمحلول يحـتـوي على 1mol من الجلوكوز C6H12O6 في 22.4L من المحلول عند °25C .
الحل:
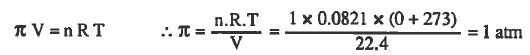
من المثال السابق نستنتج أنه إذا أذيب مول من المذاب في 22.4L عند صفر مـئـوي فإن الضغط الأسموزي الناتج يساوي ضغط جوي واحد.