طاقة جبس الحرة Gibbs Free Eneregy
- طاقـة جبس الحرة: هي خاصية ثرموديناميكية تجمع بين انتروبي وإنثالبي النظام فقط بهدف تحديد ما إذا كان التغير تلقائي أم لا.
- يمكن إيجاد التغير في طاقة جبس الحرة بالقانون التالي:
ΔG = ΔH - TΔS
ΔG = التغير في طاقة جبس الحرة ، ووحدته kJ / mol
ΔH = التغير في الإنثالبي ووحدته kJ / mol
ΔS = التغير في الانتروبي للنظام فقط ، ووحدتها J/mol K
T = درجة الحرارة المطلقة (كلفن) ، ووحدتها K
ملاحظات على قانون حساب طاقة جبس الحرة
(1) إذا كانت قيمة ΔG بالموجب يكون التغير غير تلقائي.
ΔH - TΔS > zero ΔG > zero
(2) إذا كانت قيمة ΔG بالسالب يكون التغير تلقائي.
ΔH - TΔS < zero ΔG < zero
(3) إذا كانت ΔG يساوي صفر يكون التغير في حالة اتزان .
ΔH - TΔS = zero ΔG = zero
(4) يمكن من خلال معرفة إشارات قيم ΔS و ΔH أن نحدد كون التغير تلقائي أم لا
(5) إذا كان : 0 > ΔH و ΔS > 0 فإن 0 > ΔG أي ان التغير تلقائي .
أي أن التغير طارد للحرارة ، ويتجه نحو العشوائية (عدم الانتظام) .
(6) إذا كان : 0 < ΔH و 0 > ΔS فإن 0 < ΔG أي أن التغير غير تلقائي.
أي ان التغير ماص للحرارة ، ويتجه نحو الانتظام.
(7) إذا كان : 0 < ΔH و ΔS > 0 فإن 0 < ΔG يعتمد على درجة الحرارة كما يلي:
(أ) إذا كانت درجة الحرارة عالية فإن التفاعل تلقائي وذلك لأن زيادة درجة الحرارة يؤدي إلى أن TΔS > ΔH مما يجعل قيمة ΔG بالسالب.
(ب) إذا كانت درجة الحرارة منخفضة فإن التفاعل غير تلقائي وذلك لأن النقصان في درجة الحرارة يؤدي إلى أن ΔH > TΔS مما يجعل قيمة ΔG بالموجب.
(8) إذا كان : 0 > ΔH و 0 > ΔS فإن ΔG يعتمد على درجة الحرارة كما يلي:
(أ) إذا كانت درجة الحرارة عالية فإن التفاعل غير تلقائي وذلك لأن زيادة درجة الحرارة يؤدي إلى ان TΔS < ΔH مما يجعل قيمة ΔG بالموجب .
(ب) إذا كانت درجة الحرارة منخفضة فإن التـفـاعـل تلقائي وذلك لأن النقصان في درجـة الحرارة يؤدي إلى أن ΔH < TΔS مما يجعل قيمة ΔG بالسالب.
ويمكن تلخيص القواعد السابقة في الجدول التالي:
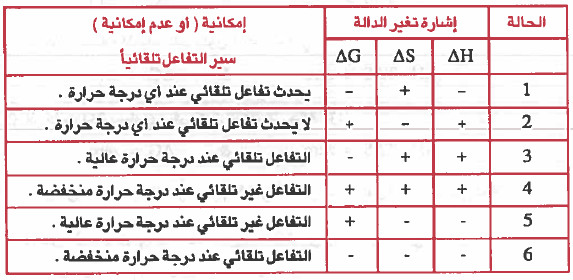
سؤال: ما العاملان الواجب توفرهما حتى تكون عملية ما تلقائية ، بغض النظر عن درجة حرارتها.
جواب: أن تكون قيمة > ΔH وقيمة 0 < ΔS
التغير في الطاقة الحرة القياسية
- تعريف التغير في الطاقة الحرة القياسية هو مقدار التغير في الطاقة الحرة اللازمة لتكوين مول واحد من مركب من عناصره الأولية في الحالة القياسية.
- الجدول التالي يوضح قيم طاقات التكوين الحرة القياسية (ΔGo) عند C° 25 و 1atm بوحدة kJ / mol
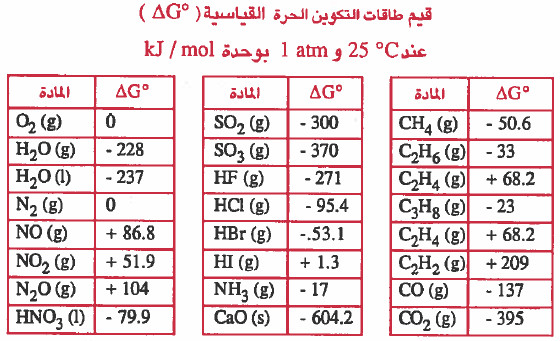
- طاقة التكوين الحرة القياسية ΔGo لأي عنصر في الحالة القياسية يساوي صفر
- يمكن إيجاد التغير في الطاقة الحرة القياسية AG للتفاعلات الكيميائية باستخدام القانون
ΔG° = ∑ ΔG° Products - ∑ ΔG° Reactants