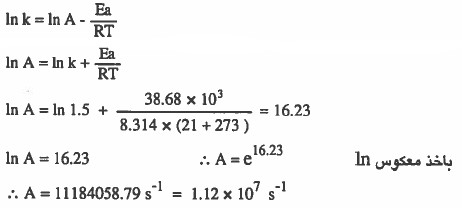معادلة أرهينيوس Arrhenius Eq
- توصل الـعـالـم أرهينيوس إلى علاقة تربط بين طاقة التنشيط ودرجـة الحـرارة وثابت سرعة التفاعل وهي كما يلي:

- ويمكن التعرف على قانون يوجد طاقة التنشيط بمعلومية درجتي حرارتين مختلفتين وثابتي السرعة وهي كما يلي:
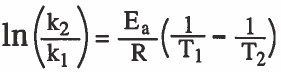
ويمكن كتابة القانون بشكل أفضل كما يلي:
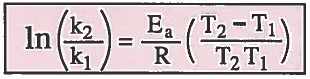
حيث أن:
k = ثابت سرعة التفاعل
A = معامل التردد (تردد التصادم)
Ea = طاقة التنشيط ووحدته J mol-1
R = ثابت الغازات وقيمته تساوي 1-8.314J mol-1 K
T = درجة الحرارة المطلقة (كالفن).
مسائل محلولة على معادلة أرهينيوس
مثال (1): التفاعل التالي:
C2H5Br → C2H4 + HBr
من الرتبة الأولى بالنسبة للمادة (C2H5Br) فإذا كانت قيمة ثابت سرعة التفاعل عند 650K تساوي 5-10 × s-1 2 وعند 667.5K تسـاوي 5-10 × s-1 6 احسب طاقـة التنشيط لهذا التفاعل بوحدة الكيلو كالوري (kcal) . ثم احسب قيمة الثابت (A).
الحل:

مثال (2): مستفيداً من الجدول التالي احسب طاقة التنشيط لهذا التفاعل

الحل:

مثال (3): التفاعل التالي:
C2H4 (g) + H2(g) → C2H6(g)
إذا علمت أن طاقة التنشيط تساوي (181kJ / mol) وأن ثابت معدل سرعة التفاعل يساوي L / mol s 10-3 × 1.3 عند درجة حرارة ( 700K ) فـاحـسب ثابت مـعـدل سـرعـة الـتـفـاعل السابق عند درجة حرارة (730K) يساوي بوحدة ( L / mol s).
الحل:
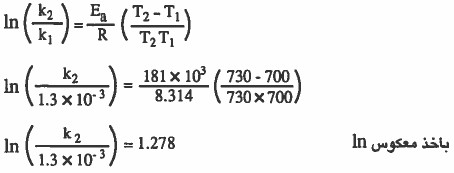
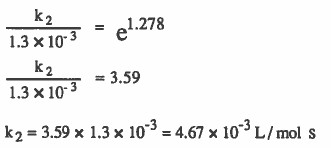
مثال (4): احسب قيمة طاقة التنشيط لتفاعل ما إذا علمت أن سرعته تزداد مرتين عند ارتفاع درجة الحرارة من 273K إلى 298K .
الحل:
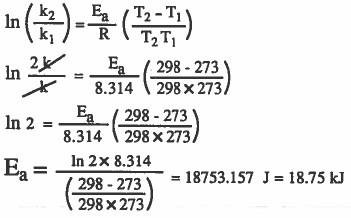
مثال (5): إذا كانت طاقة التنشيط لـتـفـاعـل مـا تساوي 38.68kJ / mol وقيمة ثابت سرعة التفاعل تساوي 1.5 s-1 عند °21C فاحسب قيمة الثابت (A) .
الحل: