مفهوم برونستد - لاوري Bronsted-Lowry للأحماض والقواعد
- يعتبر مفهوم أرهينيوس مفهوماً قاصراً لأن:
تعريف الحمض حسب مفهوم برونستد - لاوري
هي المادة التي لها قابلية لفقد البروتون أو منحه.
HCl (g) + H2O (1) = H3O+ (aq) + Cl- (aq)
تعريف القاعدة حسب مفهوم برونستد - لاوري
هي المادة التي لها قابلية لتقبل البروتون أو أخذه.
NH3 (g) + H2O (1) = NH4+ (aq) + -OH (aq)
قوة الحمض والقاعدة
- تعتمد قوة الحمض والقاعدة على:
(1) مدى قابلية الحمض لمنح بروتون مائي +H
(2) مدى قابلية القاعدة لتقبل البروتون المائي +H
يمتاز مفهوم برونستد - لاوري بانه أكثر شمولاً من مفهوم أرهينيوس (علل)
وذلك لأن مـفـهـوم أرهينـيـوس يـحـصـر الـحـمـوض والقواعد في المحاليل المائية فقط،
أمـا مـفـهـوم برونسـتـد - لاوري فإنه لا يقيدنا بالمحاليل المائية، فـمـثـلاً يـتـفـاعـل غـاز HCl مـع غـاز NH3 ليتكون NH4Cl دون أن نحتاج إلى وسط مائي لحدوث التفاعل:
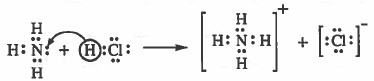
ملاحظات هامة على تعريف برونسـتـد - لاوري
من خلال التعريف نستنتج أن:
(1) لكل حمض قاعدة مقترنة
(2) لكل قاعدة حمض مقترن
(3) لإيجاد الحمض المقترن للقاعدة نضيف بروتون مائي (+H).
(4) لإيجاد القاعدة المقترنة للحمض ننزع بروتون مائي (+H).
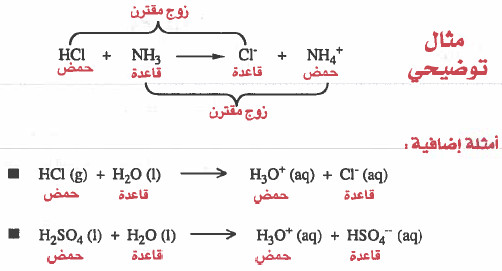
قوة الحموض والقواعد
لنأخذ المثالين التاليين:
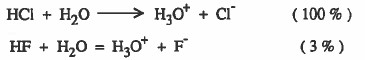
نلاحظ أن HCl يتفكك بنسبة % 100 أي أنه يمنح للماء البروتون المائي (+H) بنسبة %100 بينما HF يتفكك بنسبة %3 أي أنه يمنح للماء البروتون المائي(+H) بنسبة %3 ومن هذا نستنتج HCl حامض أقوي من HF مع نفس القاعدة وهي H2O
وللمقارنة قوة حامضية HCl مع +H3O سوف نفترض أن هذا التفاعل عكسي:
-HCl + H2O = H3O+ + Cl
وقد لوحظ من النتائج الـعـمـلـيـة مـا يدل على أن التفاعل ينزاح نحو اليمين ، وهذا يعني أنّ HCl يمنح البروتون المائي (+H) بشكل أكبر من +H3O ، لذلك فإن حامضية HCl اكبر من +H3O . وهذا أيضاً يقودنا إلى أن نقول أن قـاعـدية H2O أكـبـر من -Cl لأن قـابـلـيـة H2O لاستقبال البروتون المائي أكبر من -Cl.
أما بالنسبة للتفاعل التالي:
-HF + H2O = H3O+ + F
فقد وجد أن اتجاه الاتزان ينـحـرف نـحـو اليسار ، لذلك فإن حمض HF اضعف من +H3O وقاعدية -F أكبر من قاعدية H2O .
نستنتج مما سبق ما يلي:
- كلما زادت قوة الحمض فإن قاعدته المقترنة تصبح أضعف
- كلما زادت قوة القاعدة فإن حمضها المقترن يصبح أضعف
- عند حدوث تفاعل كيميائي بين حمض وقاعدة فإن اتجاه الاتزان يكون في اتجاه الحمض والقاعدة الأضعف
مثال : حسب التفاعلين التاليين:
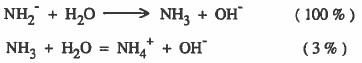
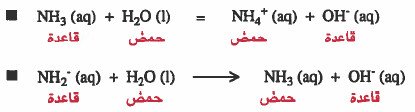
إذن نستنتج من المثالين السابقين ما يلي:
- أن قاعدية -NH2 أكبر من قاعدية NH3 مع نفس الحمض وهو H2O ، لأن قابلية -NH2 لاستقبال البروتون المائي أكبر من NH3.
- نظراً لان أيون ( -NH2) قاعدة أقوى من النشادر NH3، فإن أيون +NH4 حمض أقوى من النشادر NH3.
- ملاحظة : قابلية +NH4 لمنح بروتون أكبر من NH3 نحو نفس القاعدة وهي OH-
سؤال : إذا كان (CH3COOH) حمضاً اضعف من (HNO2) فأي القاعدتين التاليتين اقوى ( -CH3COO) ام ( -NO2)؟
جواب: القاعدة المقترنة الأقوى هي: ( -CH3COO )