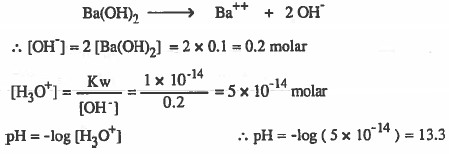القواعد القوية Strong Bases
- تعريف القاعدة القوية: هي مادة تتفكك كلياً في الماء وتعطي أيونات الهيدروكسيد.
- وبذلك يمكن إيجاد تركيز أيونات الهيدروكسيد كما يلي:
(1) بالنسبة للقواعد الأحادية مثل :
(أ) هيدروكسيد الصوديوم (NaOH):
NaOH (s) + H2O → Na+ (aq) + OH- (aq)
(ب) هيدروكسيد البوتاسيوم (KOH):
KOH (s) + H2O → K+ (aq) + OH- (aq)
في حالة القواعد القوية الأحادية فقط فإن:
تركيز ايونات الهيدروكسيد ( -OH ) = تركيز القاعدة
[-OH] = [NaOH]
[-OH] = [KOH]
(2) بالنسبة للقواعد القوية الثنائية مثل:
هيدوكسيد الباريوم Ba(OH)2:
-Ba(OH)2 + H2O → Ba2+ + 2 OH
في حالة القواعد الثنائية فقط فإن :
تركيز ايونات الهيدروكسيد (-OH ) = ضعف تركيز القاعدة
[-OH] = [Ba(OH)2]2
ملاحظة هامة
- هناك بعض الهيدروكسيدات مـثل هيدروكسيد الكالسيوم 2(Ca(OH أو هيدروكسيد المغنيسيوم 2(Mg(OH شحيحة الذوبان في الماء ، ولكن ما يذوب منها في الماء يتفكك ليعطي مولين من أيونات الهيدروكسيد (-OH)
-Ca(OH)2 + H2O → Ca2+ + 2 OH
-Mg(OH)2 + H2O → Mg2+ + 2 OH
- ولذلك يجب الحذر عند التعامل مع هذا النوع من المسائل ، لأنه مثلاً ليس كل ما يوضع من هيدروكسيد الكالسيوم 2(Ca(OH في الماء يذوب كلياً.
سؤال: هل نستطيع بالنسبة لحمض الكبريت أن نقول أن:
[+H3O] = [H2SO4]2
2-H2SO4 + H2O → 2 H3O+ + SO4
جواب:
لا يمكن ذلك لأن حمض يتفكك في الماء على مرحلتين:
-H2SO4 + H2O → 2H3O+ + HSO4
عال جداً = Ka
-HSO4- + H2O → H3O+ + SO4
Ka = 1.2 x 10-2
مما سبق يبدو أنك لاحظت انه في المرحلة الأولى التفكك كلي ، أما المرحلة فالتفكك ضعيف.
ولكي تنطبق القاعدة السابقة:
[+H3O] = [H2SO4]2
يجب أن يكون التفكك في المرحلتين كلياً
مسائل محلولة على حساب pH للقواعد القوية

مثال (1): أحسب الأس الهيدروجيني لمحلول NaOH ترکیزه (0.01M)
الحل:
بما أن القاعدة قوية:
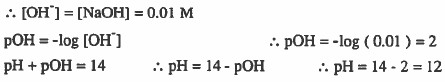
مثال (2): إذا أذيب (0.5mol) هيدروكسيد البوتاسيوم KOH في الماء وتكون محلول حجمه (10L) احسب الرقم الهيدروجيني.
الحل:
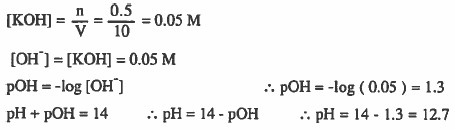
مثال (3): احسب تركيز اليونان أيونات +H3O في محلول مـائي يـحتـوي (1.6g) من هيدروكسيد الصوديوم NaOH في (100mL) من المحلول. الأوزان الذرية : 14 = O = 16 , H = 1 , N
الحل:
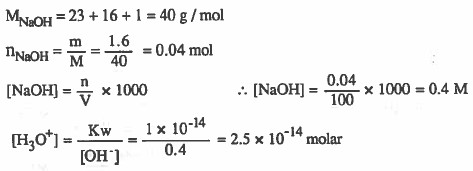
مثال (4): محلول هيدروكسيد الصوديوم NaOH قيمة pH له تساوي10.7 فكم يكون تركيز محلول هيدروكسيد الصوديوم.
الحل:
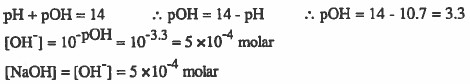
مـثـال (5): احسب الأس الهيدروجيني لمحلول مـائـي تـركـيـزه (0.1M) مـن هيدروكسيد الباريوم 2(Ba(OH
الحل:
لاحظ ان القاعدة ثنائية القاعدية اي ان تركيز ايونات ( OH ) = ضعف تركيز القاعدة