القواعد الضعيفة Weak Bases
- القاعدة الضعيفة: هي مادة تتفكك جزئياً في الماء إلى أيونات الهيدروكسيد (-OH)
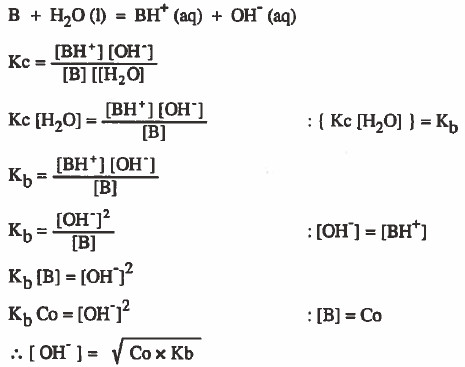
- وفي حالة القواعد الضعيفة نستخدم القانون التالي:
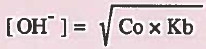
حيث أن:
Co = التركيز الأصلي للقاعدة الضعيفة.
Kb = ثابت تفكك القاعدة الضعيفة.
ملاحظة هامة:
كلما زادت قيمة Kb زادت قيمة [-OH] ومن ثم زادت قوة القاعدية.
ثابت تفكك القاعدة الضعيفة
هو ثابت اتزان تفاعل انتقال البروتون من الماء إلى القاعدة الضعيفة.
أمثلة على القواعد الضعيفة
- النشادر (الأمونيا) NH3
(Kb = 1.8 x 10-5)
-NH3 + H2O = NH4+ + OH
- ميثيل أمين CH3NH2
(Kb = 4.2 × 10-4)
-CH3NH2 + H2O = CH3NH3+ + OH
- هيدروكسيد أمين NH2OH
(Kb = 1.1 x 10-8)
-NH2OH + H2O = NH3OH+ + OH
- هيدرازين N2H4
(Kb = 1.7 x 10-6)
-N2H4 + H2O = N2H5+ + OH
- بيريدين C5H5N
(Kb = 1.7 x 10-9)
-C5H5N + H2O = C5H5NH+ + OH
- أنيلين C6H5NH2
(K = 8.3 x 10-10)
-C6H5NH2 + H2O = C6H5NH3++ OH
مسائل محلولة على حساب الرقم الهيدروجيني pH للقواعد الضعيفة
مثال (1): احسب قيمة OH-] ، [H3O+] ، pOH ، pH] لمحلول تركيزه 0.1M من النشادر(NH3) علماً بأن ثابت تفكك النشادر يساوي 5-10 × 1.8
الحل:
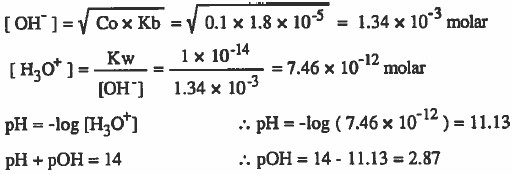
مثال (2): أذيب (0.15mol) من هيدروكسيل أمين (NH2OH) في كـمـيـة من الماء بحيث أصبح حجم المحلول (500mL) احسب قيمة H3O+] [OH-] ، pOH ، pH]
علماً بان : 9-10 × 9.1 = Kb
الحل:
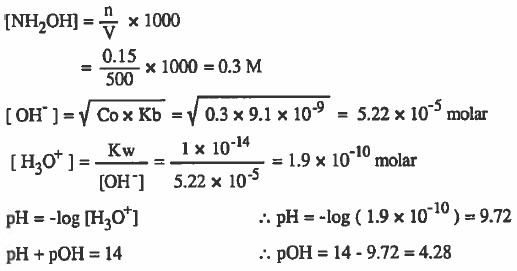
مثال (3): أذيب (0.5g) من الأمونيا (NH3) في كمية من الماء بحيث أصبح حجم المحلول لتر واحد ، احسب قيمة OH-] ، [H3O+] ، pOH ، pH]
ثابت تابن الامونيا 5-10 × 1.8 = Kb
الأوزان الذرية = (H =1 , N = 14)
الحل:

مثال (4): احسب ( Kb ) لقاعدة ضعيفة ، إذا علمت أن قيمة 11.5 = pH لمحلول ترکیزه (2M).
الحل:
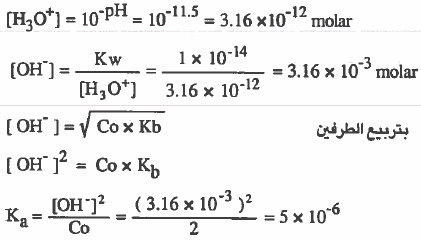
مـثـال (5): أحـسـب ثابت التفكك لقـاعـدة ضعيفة BOH إذا علمت ان الأس الهيدروجيني لمحلولها يساوي (11) وأن (0.28g) من القاعدة مذابة في (5L) من المحلول ، علماً بأن الوزن الجزيئي للقاعدة تساوي (56)
الحل:
