الذائبية وحاصل الإذابة Solubility and Solubility Product
- تذوب المركبات الكيميائية في الماء بنسب مختلفة، فمثلاَ نترات البوتاسيوم ذائبيتها مرتفعة في الماء ، أما كلوريد الفضة فذائبيته منخفضة.
- وتعتمد الذوبانية على:
(۱) درجة الحرارة.
(۲) طبيعة المذاب والمذيب.
- عند وضع كمية من كلوريد الفضة (AgC1) في الماء فإن جـزء قليل جداً يذوب في الماء ويتفكك كلياً إلى أيونات ( -Ag+ , Cl) ، أما المتبقي من كلوريد الفضة فيترسب في قاع الإناء ،ويكون في توازن كيميائي مع الأيونات المذابة ، كما يلي:
AgCl (s) ↔ Ag+ (aq) + Cl- (aq)
وبالتالي فإن حاصل الإذابة ( Ksp ) كما يلي:
Ksp=[Ag+] [Cl-]
تعريف حاصل الإذابة Ksp
- حاصل الإذابة (Ksp) هو ثابت قيمته تساوي حاصل ضرب تراكيز الأيونات مرفوعاً كل منها إلى أس يساوي معامله في المعادلة الموزونة.
- ويمكن التعرف على حاصل الإذابة Ksp بمعرفة الذائبية للملح (S)
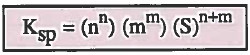
حيث أن:
Ksp = حاصل الذائبية
S = الذائبية (تركيز الملح في محلول مشبع) بوحدة (mol / L) أو (molar)
n = عدد أيونات الأيون الموجب الناتج عن تفكك جزيء واحد.
m = عدد أيونات الأيون السالب الناتج عن تفكك جزيء واحد.
- وإذا أعطيت الذائبية (للتركيز) بوحدة (g/L) فيمكن تحويلها إلى (mol / L) بالقسمة على الوزن الجزيئي:
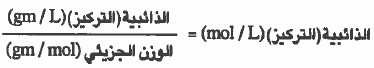
كيفية التعرف على تكون الراسب من عدمه
الطريقة الأولى: من قيمة الذائبية (S).
- إذا كان لدينا ملح كلوريد الفضة AgCl ذائبيته (S) تساوي 1.34x 10-5 mol/L أي أن إذا كان لدينا لتر من المحلول المائي فيمكن أن يذوب فـيـه كـحـد اقـصى من كلوريد الـفـضـة (AgCl) المقدار : 1.34x 10-5 mol/L فقط .
فماذا يمكن ان نستفيد من معرفة قيمة الذائبية ؟
(1) إذا أضفنا كمية من AgCl أقل من (1.34x 10-5 mol) إلى لتر من المحلول
فإن هذه الكمية تذوب بالكامل ، ولذلك المحلول في هذه الحالة يسمى محلول غير مشبع.
(2) إذا أضفنا كمية من AgCl مقدارها ( 1.34x 10-5 mol) إلى لتر من المحلول
فإن هذه الكمـيـة تذوب بالكامل ، وعند إضـافـة أي كـمـيـة أخـرى سوف تترسب ( لن تذوب ) ، ويصبح هناك توازن بين المذاب والراسب ، أي ان سرعة الذوبان تساوي سرعة الترسيب ، ويقال في هذه الحالة ان المحلول مشبع .
(3) إذا أضفنا كمية من AgCl أكثر من (1.34x 10-5 mol) إلى لـتـر من المحلول
وذابت هذه الكميـة بالتسخين ، ثم برد المحلول ولم يترسب عندئذ يسمى المحلول فـوق المشبع. ويمكن المساعدة في الترسيب بإضافة بلورة إلى المحلول فوق المشبع أو تحريكه ، عند ذلك تنزل البلورات ويصبح المحلول مشبعاً من جديد .
الطريقة الثانية:
- إذا كان لدينا ملح كلوريد الفضة AgCl وكان:
حاصل الإذابة ( Ksp ) = 1.8 x 10-10
AgCl (s) = Ag+ (aq) + Cl- (aq)
- إذا أضفنا كمية من أيونات (+Ag) وكمية من ايونات (-Cl) فإنه:
(1) إذا كـان (الحاصل الايوني Q) أي حاصل ضرب [-Cl] × [+Ag] يساوي Ksp
فإن المحلول في هذه الحالة يسمى محلول مشبع ولا يوجد راسب.
(2) إذا كـان (الحاصل الايوني Q) أي حاصل ضرب [-Cl] × [+Ag] أقل من Ksp
فإن المحلول في هذه الحالة يسمى محلول غير مشبع ولا يوجد راسب.
(3) إذا كـان (الحاصل الايوني Q) أي حاصل ضرب [-Cl] × [+Ag] أكبر من Ksp
فإن المحلول في هذه الحالة يسمى محلول فوق مشبع ، وسوف يتكون راسب.
مثال محلول: اكتب قانون ثابت الاتزان (تعـبـيـر حـاصل الذائبية) للأملاح التالية:
AgBr , PbBr2 , Ca3(PO4)2
الحل:
