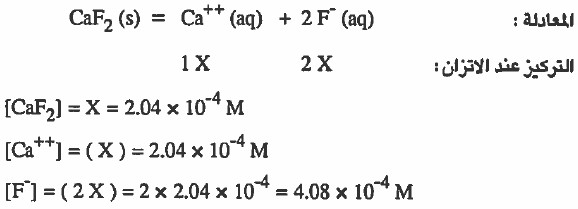مسائل محلولة على قانون حاصل الإذابة Ksp؟
مثال (1): اكتب قانون ثابت الاتزان (تعـبـيـر حـاصل الذائبية) للأملاح الآتية كما يلي:-
AgBr , PbBr2 , Ca3(PO4)2
الحل:

مـثـال (2): وضع فلوريد الـبـاريوم BaF2 في كـمـيـة من الماء فـوجـد أن تركـيـز الأيونات في المحلول المشبع كما يلي:
10-2 × 1.82 = [+Ba2]
10-2 × 3.64 = [-F]
فاحسب ثابت حاصل الإذابة Ksp
الحل:
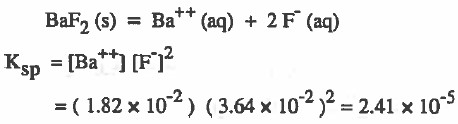
مثال (3): وضع هيدروكسيد الكروم 3(Cr(OH في الماء فإذا كان تركيز أيونات الكروم (+Cr3) في المحلول المشبع M 10-8 × 1.39 فاحسب تركيز ايونات الهيدروکسید في المحلول المشبع . وما تركيز أيونات الهيدروكسيد اللازم ليحدث ترسيب لهيدروکسید الكروم Ksp = 1 × 10-30
الحل:
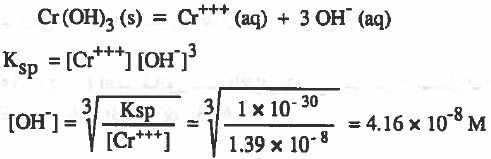
لكي يبدأ الترسيب لهيدروكسيد الكروم Cr(OH)3 يجب أن يزيد تركيز أيونات الهيدروكسيد عن 8-10 × 4.16 M
مثال (4): أوجد العلاقة بين حـاصل الإذابة والذوبانية (S) للمـركـبـات التـاليـة:
(1) CaSO4
(2) Ag2S
(3) Bi2S3
الحل:

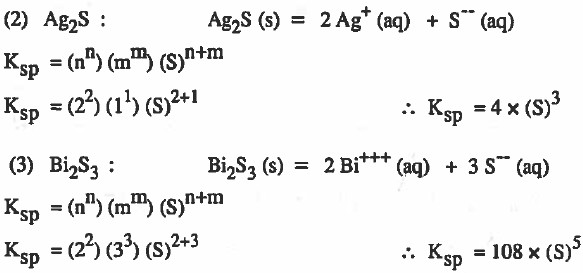
مثال (5): إذا كان تركيز محلول مشبع من PbBr2 هو 0.024M فاحسب حاصل الإذابة Ksp؟
الحل:
( تركيز المحلول المشبع = الذائبية )
الطريقة الأولى: (باستخدام القانون)
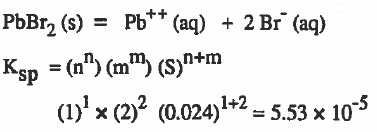
الطريقة الثانية:
إذا تفكك من PbBr2 مقدار (X molar) منه فإن:
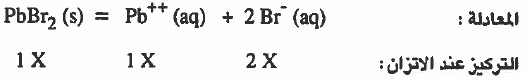
وبالتالي إذا عرفنا قيمة ( X ) فيمكن معرفة Ksp .
ومن السؤال تركيز PbBr2 الذائب في المحلول يساوي 0.024M أي أن (X = 0.024 M )
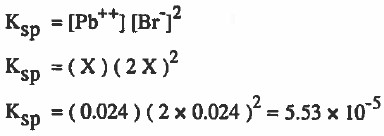
مثال (6): إذا كانت ذائبية فوسفات الفضة Ag3PO4 في الماء تساوي 0.0067g/L عند °25C أحسب ثابت حاصل الإذابة Ksp للملح عند °25C .
الأوزان الذرية : 16 = P = 31 , Ag = 107.9 , O
الحل:
لاحظ ان الذائبية بوحدة (g / L) لذلك نحـولهـا إلى (mol / L) بالقسمة على الوزن الجزيئي .
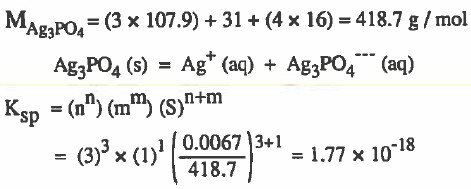
مـثـال (7): إذا علمت أن ثابت الاتزان (Ksp) لفلوريد الكالسيوم CaF2 يساوي 11-10 × 4 فاحسب ذائبية فلوريد الكالسيوم (تركيز فلوريد الكالسيوم في المحلول المشبع) بوحدة :
(أ) مول / لتر
(ب) جم / لتر
علماً بأن الوزن الجزيئي لفلوريد الكالسيوم = gm / mol 78.1
الحل:
نوجد في البداية الذائبية (تركيز CaF2 في المحلول) ، ومنه يمكن إيجاد تركيز الأيونات:
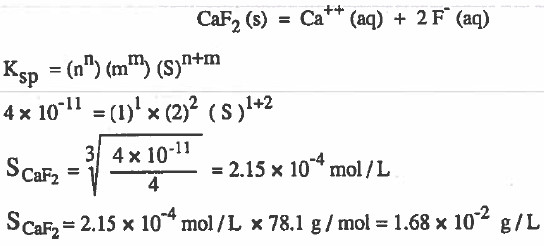
مثال (8): ما التركيز اللازم لأيونات -C2+, F ليتشبع لتر من المحلول المائي إذا علمت أن ( 11-10 Ksp (CaF2) = 3.4 x ) .
الحل:
نوجد في البداية الذائبية ( تركيز CaF2 في المحلول) ، ومنه يمكن إيجاد تركيز الايونات:
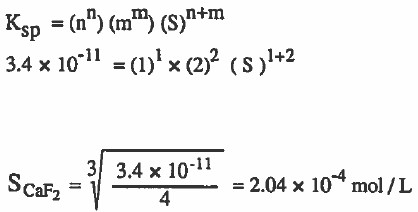
تركيز CaF2 في المحلول = 4-10 × 2.04 M
إذا تفكك من CaF2 مقدار (X molar) منه فإن: