تعيين ثابت الاتزان بطريقة الانتشار
نظرية التجربة
- يحدث التفاعل العكسي التالي بالمحاليل المائية كما يلي:
KI + I2 → KI3
- وحسب قانون فعل الكتلة يعطي ثابت الاتزان Kc كما بالمعادلة الآتية:
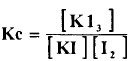
- ويمكن تحري الاتزان بدراسة انتشار اليود بين المذيب العضوي والماء، يتبعها دراسة مماثلة وهي انتشار اليود بين المذيب العضوي نفسه ومحلول يوديد البوتاسيوم المائي، إذ تكمننا الدراسة الأولى لحساب معامل التوزع من العلاقة:
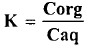
حيث C تركيز اليود ( تعين بالمعايرة).
- وإذا لم ينطبق قانون الانتشار على الأنواع العامة لكلا الطبقتين، يمكن حساب تركيز اليود الحر بالطبقة المائية لمحلول يوديد البوتاسيوم Cki, aq من العلاقة:
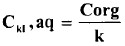
- لذا يمكن تعيين اليود المتحد مع يوديد البوتاسيوم لتكوين KI وذلك الإمكانية تحديد اليود الكلي بطبقة يوديد البوتاسيوم بالمعايرة.
- هناك إمكانية إيجاد كمية اليوديد المتحد مع اليود ومعرفة التركيز البدائي لليوديد يمكن معرفة كمية اليوديد غير المتحد بفرق الكميتين. لهذا يمكن حساب قيمة Kc.
الأدوات والكيماويات اللازمة للتجربة
- ثلاثة دوارق مع سداداتها ذات حجم 350 سم
- ثرموستات
- 0.1 من يوديد البوتاسيوم
- يود
- رابع كلوريد الكربون
- 0.1 من ثيو كبريتات الصوديوم
خطوات التجربة
- يمزج 20 مل من محلول رابع كلوريد الكربون المشبع باليود مع 200 مل ماء بإحدى الدوارق الزجاجية.
- توضع القنينة بالثرموستات عند درجة الحرارة 25مo ، وتترك ومحتوياتها للوصول إلى الاتزان الحرارة.
- تتبع الطريقة السابقة نفسها باستخدام 15 مل من رابع كلوريد البوتاسيوم يؤخذ 50 مل من طبقة المحلول المائي و 5 مل من طبقة المحلول العضوي كنماذج من كل خليط ثم تحلل باستخدام 0.1N و 0.01N من ثيو كبريتات الصوديوم حسب كمية اليود الموجودة بالنماذج.
- تضاف كمية قليلة من يوديد البوتاسيوم المركز للمحلول العضوي للتأكد من استخلاص اليود التام.
- تعاد الطريقة بأكملها باستخدام 0.1 من يوديد البوتاسيوم عوضاً عن الماء واستخدام 20 ، 15 و 10 مل من محلول اليود المشبع برابع كلوريد الكربون كما تمت إضافته سابقاً.