الترتيبات الإلكترونية للكاتيونات Electron Configurations for Cations
- تعرف أن الغازات النبيلة مثل النيون والأرجون قليلة النشاط في التفاعلات الكيميائية.
- عام 1916، استخدم العالم الكيميائي جيلبرت لويس Gilbert Lewis شكل (40) هذه الحقيقة لتفسير السبب في تكوين الذرّات لأنواع معينة من الأيونات والجزيئات، وأطلق على هذا التفسير اسم قاعدة الثمانية Octet Rule.
- تنص قاعدة الثمانية على أن: الذرات تميل إلى بلوغ الترتيب الإلكتروني الخاص بالغاز النبيل خلال عملية تكوين المركبات.
بمعنى آخر، إن الذرّة تميل إلى اكتساب أو فقدان إلكترونات إلى أن يصبح هناك ثمانية إلكترونات في غلاف التكافؤ.
- تذكر أن كل غاز نبيل (ما عدا الهيليوم يحتوي على ثمانية إلكترونات في مستوى طاقته الأعلى وأن الترتيب الإلكتروني الخاص به هو ، بشكل عام ، ns2 np2.
- على هذا الأساس، فإنّ تسمية قاعدة الثمانية تعود إلى الترتيب الإلكتروني الخارجي للغازات النبيلة.
(1) تطبيق قاعدة الثمانية Octet Rule
- تميل ذرات العناصر الفلزية إلى فقدان إلكترونات التكافؤ الخاصة بها حيث تبقى ثمانية إلكترونات كاملة في مستوى الطاقة السابق الأقل طاقة.
- تميل ذرات بعض عناصر اللافلزات إلى اكتساب أو مشاركة إلكترونات عنصر لا فلزي آخر لتبلغ الترتيب الثماني.
- على الرغم من وجود بعض الحالات الشاذة، إلا أن قاعدة الثمانية تنطبق على معظم الذرّات في المركبات.
- عندما تفقد الذرّة إلكترونات التكافؤ فإنّها تصبح كاتيوناً.
- تتكون معظم الكاتيونات المعروفة نتيجة فقدان ذرات الفلزات لإلكترونات تكافؤها ، ومعظم هذه الفلزات لها من إلكترون تكافؤ واحد إلى ثلاثة إلكترونات تكافؤ من السهل فقدانها أو نزعها.
- يُعتبر الصوديوم في المجموعة 1A نموذجًا لمثل هذه الفلزات.
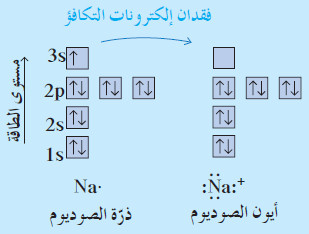
- يساوي العدد الكلي للإلكترونات في ذرّة الصوديوم 11 إلكتروناً متضمّنا إلكترون تكافؤ واحدًا.
- عند تكوين مركب ما ، فإنّ ذرّة الصوديوم تفقد إلكترون تكافؤها تاركة ثمانية إلكترونات في غلاف الطاقة السابق.
- نظرًا لأنّ عدد البروتونات في نواة الصوديوم لا يزال يساوي 11 ينتج من فقدان وحدة واحدة من الشحنة السالبة أيون ذو شحنة موجبة (1+) .
- يمكنك تمثيل عملية فقدان إلكترون أو تأين ذرة الصوديوم عبر كتابة الترتيب الإلكتروني الكامل للذرة والأيون المتكون:

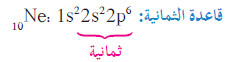
- يوضح الشكل التالي أنّ الترتيب الإلكتروني لأيون الصوديوم مماثل للغاز النبيل (النيون).

- توجد في أغلفة تكافؤ كلّ من أيون الصوديوم والنيون ثمانية إلكترونات.
- يمكن توضيح عملية التأين لذرّة الصوديوم ببساطة أكثر ، وذلك باستخدام الترتيب الإلكتروني النقطي كما يلي:

- ينتمي المغنيسيوم العدد الذري (12) إلى المجموعة 2A في الجدول الدوري، ولهذا يوجد إلكترونان في غلاف التكافؤ للذرّة الخاصة به . ولكي تصل هذه الذرة إلى الترتيب الإلكتروني للنيون فإنّها تفقد كلا الإلكترونين، ما يؤدي إلى تكون كاتيون المغنيسيوم الذي يحمل شحنة موجبة ضعف الشحنة التي يحملها كاتيون الصوديوم.

- لاحظت مما درست أن كاتيونات عناصر المجموعة 1A شحنتها دائمًا (+1) وأن كاتيونات عناصر المجموعة 2A شحنتها (+2) .
- يمكن تفسير هذا الثبات في شحنة عناصر المجموعة الواحدة في ضوء فقدان ذرات الفلز لإلكترونات التكافؤ.
- تفقد الذرّات عددًا كافيًا من الإلكترونات كي تصل إلى الترتيب الإلكتروني للغاز النبيل.
- وعلى سبيل المثال، تحتوي كل عناصر المجموعة 2A على إلكترونين يؤدي فقدانهما إلى تكوّن كاتيونات شحنتها (+2).
- أما بالنسبة إلى الفلزات الانتقالية فقد تختلف شحنات الكاتيونات . مثلاً قد تفقد ذرّة الحديد إلكترونين أو ثلاثة إلكترونات.
- في الحالة الأولى، يتكون كاتيون حديدوز أو حديد (Ferrous) Fe2+ (II)، وفي الحالة الثانية يتكوّن كاتيون حديديك أو حديد (Ferric Fe3+ (III) (شكل (42) .
(2) الترتيب الإلكتروني الشاذ لبعض العناصر من قاعدة الثمانية
- بعض الأيونات الناتجة من الفلزات الانتقالية لا تتمتع بالترتيبات الإلكترونية نفسها التي تُميّز الغاز النبيل أي (ns2np6) . ولذا، تعتبر هذه الأيونات شاذة عن قاعدة الثمانية
- مثال ذلك الفضة
Ag47 :1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
- على ذرة الفضة أن تفقد أحد عشر إلكتروناً بهدف بلوغ الترتيب الإلكتروني الخاص بالكربتون ، وهو غاز نبيل يسبق الفضّة في الجدول الدوري.
- أما لبلوغ الترتيب الإلكتروني الخاص بالزينون ، وهو غاز نبيل يلي الفضة في الجدول الدوري، فعلى ذرّة الفضة أن تكتسب سبعة إلكترونات.
- الأيونات التي تحمل ثلاث وحدات من الشحنات أو أكثر هي غير شائعة ، وإمكانية وجودها نادرة.
- لذلك، فإنّ الفضّة لا تصل إلى الترتيب الإلكتروني للغاز النبيل، ولكن إذا فقدت ذرّة الفضة الإلكترون 5s1 ، فإن الترتيب الإلكتروني الذي ينتج عن ذلك الفقدان يكون Ar]18 4s2 3d10 4p6 4d10] ويضم 18 إلكتروناً في مستوى ا الأفلاك الطاقة الخارجي (4) = n وجميع الأفلاك الذرية فيه ممتلئة ، هو ترتيب مفضّل نسبيًّا في المركبات الفضية.
- بهذه الطريقة ينتج عن الفضة كاتيون موجب +Ag .
- تسلك عناصر أخرى سلوكًا مشابها للفضّة. وهي العناصر التي تقع على يمين قطاع الفلزات الانتقالية IIB.
- مثال آخر موضح في الشكل التالي: حيث يتمتع كل من كاتيونات النحاس (Cu+ (I والذهب (Au+ (I والكادميوم (Cd2+ (II والزئبق (Hg2+ (II بترتيب إلكتروني شاذ عن قاعدة الثمانية.
