قانون فعل الكتلة Mass Action law
ينص على أنه:
عند ثبوت درجة الحرارة تتناسب سرعة التفاعل الكيميائي طردياً مع حاصل ضرب تركيز المواد المتفاعلة (كلاُ منها مرفوع لأس يساوي عدد مولات الجزئيات أو الأيونات فى معادلة التفاعل الموزونة.
- إذا كان لدينا التفاعل المتزن التالي:
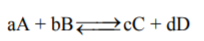
وبافتراض أن سرعة التفاعل الأمامي هي (Rate (f ، وسرعة التفاعل العكسي (Rate (r
وبتطبيق قانون فعل الكتلة
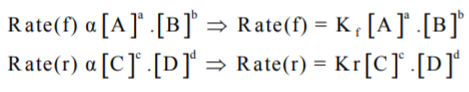
حيث Kf : ثابت سرعة التفاعل الأمامي ، Kr : ثابت سرعة التفاعل العكسي.
عند الآتزان فأن: سرعة التفاعل الأمامي = سرعة التفاعل العكسي ويكون:

ثابت الإتزان الكيميائي Equilibrium Constant
- يرمز له بالرمز Keq واختصاراُ K
- ھو عبارة عن النسبة بين ثابت تناسب سرعة التفاعل الأمامي ، وثابت سرعة التفاعل الخلفي.
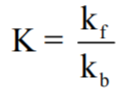
- أو هو حاصل ضرب تركيزات المواد الناتجة عند الإتزان مرفوعاً لأس عدد جزيئاتها مقسوماً على حاصل ضرب تركيزات المواد المتفاعلة عند الأتزان مرفوعاً لأس عدد جزيئاتها.
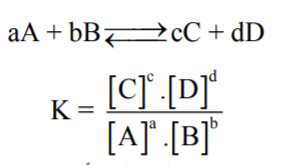
- مثال لحساب الآتزان الكيميائي للمعادلة التالية:
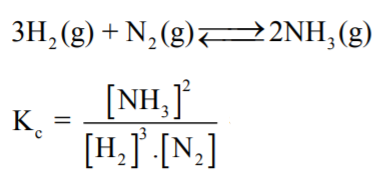
- عند استخدام التراكيز المولارية للمواد المتفاعلة والناتجة في معادلة الإتزان فإن ثابت الإتزان يرمز له بالرمز Kc.
- أما عند استخدام الضغوط الجزئية في حالة إذا كانت المواد المتفاعلة والناتجة عبارة عن غازات فيرمزلثابت الإتزان الكيميائي بالرمز Kp
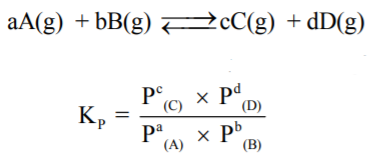
ملاحظات هامة
(1) يستخدم قانون Kp إذا كانت المواد في الحالة الغازية فقط، لأن الضغط لا يؤثر إلا على الغاز. (تركيز الغاز هو ضغطه).
(2) المواد التي تكون في حالة صلبة (S) أو سائلة (L) (كمذيب) لا تكتب تراكيزھا في قانون ثابت الإتزان وذلك لأن تركيزھا يبقى ثابتاً أثناء التفاعل الكيميائي (تعتبر قيمتھا تساوي الوحدة) مھما اختلفت كميتھا عند درجة حرارة معينه.
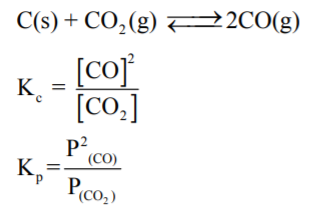
نصوص أخري لقانون فعل الكتلة
ھناك نصوص متعددة لھذا القانون كلھا تقود لنفس المدلول ومنھا :
(1) معدل التفاعل الكيميائي يتناسب مع الكتلة النشطة للمواد المتفاعلة.
(2) عند ثبوت درجة الحرارة فإن سرعة التفاعل الكيميائي تتناسب طردياً مع الكتلة الفعالة من المواد المتفاعلة وھذه الكتل الفعالة تتناسب طرديا مع التركيز.
(3) تعبير فعل الكتلة (Mass Action Expression) هي النسبة بين حاصل ضرب تراكيز المواد الناتجة عند الإتزان كل منھا مرفوع لآس يساوي عدد مولاته في المعادلة الكيميائية، وحاصل ضرب تراكيز المواد المتفاعلة عند الإتزان كل منھا مرفوع لأس يساوي عدد مولاته في المعادلة الكيميائية.
وهذة النسبة تساوي مقداراً ثابتاً لنفس التفاعل ولا تتغير بتغير الظروف عدا ظرف درجة الحرارة.